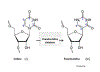|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
EM INGLES |
VIROLOGIA - CAPÍTULO OITO
VACINAS: SUCESSOS
PASSADOS E PERSPECTIVAS FUTURAS
DA VARÍOLA AO
COVID-19
Dr. Richard Hunt
Professor
Universidade da Carolina
do Sul, Escola de Medicina
Columbia
Carolina do Sul
Tradução:
PhD. Myres Hopkins
|
|
En
Español |
|
SHQIP - ALBANIAN |
|
TURKISH |
Let us know what you think
FEEDBACK |
|
APRENDA PLUGADO |
|
|
|
|
|
Ver também
APPÊNDICE
Redução da incidência de certas doenças após a introdução da vacinação
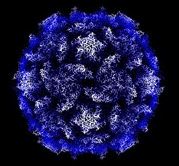
Polio Virus (From the Hogle Lab at Harvard, URL unknown)
Many of the images in the smallpox part of this file come from
Fenner, Henderson, Arita et
al. Smallpox and its Eradication. 1988 Geneva, World Health Organization and were
assembled by Laura Gregorio in her essay The Smallpox Legacy, Pharos. Fall 1996
|
INTRODUÇÃO
O que é uma
vacina?
Vacinas são agentes inofensivos,
percebidos como inimigos. São moléculas, geralmente, mas não necessariamente
proteínas, que provocam uma resposta imune, fornecendo assim imunidade
protetora contra um patógeno em potencial. Embora o patógeno possa ser uma
bactéria ou mesmo um protozoário eucariótico, a maioria das vacinas bem
sucedidas foram produzidas contra vírus e aqui lidaremos com vacinas
antivirais. As vacinas podem consistir em uma proteína purificada, ácido
nucleico ou um complexo de moléculas ou até mesmo uma bactéria ou vírus
inteiro.
A imunidade a um vírus normalmente
depende do desenvolvimento de uma resposta imune a antígenos na superfície
de uma célula que tenha sido infectada por um vírus ou na superfície da
partícula viral propriamente. As respostas imunes aos antígenos internos
geralmente desempenham pouco papel na imunidade. Assim, nas pandemias de
influenza, uma nova glicoproteína de superfície adquirida como resultado de
uma alteração antigênica caracteriza a nova cepa do vírus contra a qual a
população tem pouca ou nenhuma imunidade. Esta nova cepa de vírus da
influenza pode, no entanto, conter proteínas internas que estiveram em cepas
anteriores de influenza. Glicoproteínas de superfície são frequentemente
referidas como antígenos protetores. Para fazer uma vacina bem sucedida
contra um vírus, a natureza desses antígenos superfície deve ser conhecida a
menos que a abordagem empírica da vacina passada seja mantida. Deve-se notar,
no entanto, que uma célula infectada por um vírus exibe fragmentos de
antígenos internos do vírus em sua superfície e estes podem gerar uma
resposta celular T citotóxica que age contra a célula infectada.
Pode haver mais de uma glicoproteína de
superfície em um vírus e uma delas pode ser mais importante na resposta
imune protetora do que as outras; este antígeno deve ser identificado para
uma vacina lógica que bloqueia a infectividade. Por exemplo, o vírus da
influenza tem uma neuraminidase e uma hemaglutinina na superfície da
partícula do vírus. É a hemaglutinina que provoca a imunicade neutralizante
porque é a proteína que liga o vírus a um receptor de superfície celular e o
anticorpo neutralizador interfere com a ligação do vírus à célula.
Além de bloquear a fixação da célula ao
vírus, outros fatores podem ser importantes na neutralização dos vírus; por
exemplo, o complemento pode lisar vírions envelopados após a opsonização por
anticorpos antivirais.
Neste capítulo, lidamos principalmente
com vacinas antivirais, embora também existam vacinas antibacterianas bem
sucedidas (veja
aqui).
|
|
WEB RESOURCES
Common Misconceptions about Vaccination and how to respond to them |
Principais
locais de infecção viral
Para desenvolver uma vacina bem sucedida,
algumas características da infecção viral devem ser conhecidas. Um deles é o
local em que o vírus entra no corpo. Três principais locais podem ser
definidos:
·
Infecção através de
superfícies mucosas do trato respiratório e trato gastro-intestinal.
o
As famílias de vírus neste
grupo são:
rinovirus;
mixovirus;
coronavirus;
parainfluenzavirus;
vírus
respiratórios sinciciais;
rotavirus
·
Infecção por superfícies mucosas
seguidas de disseminação sistemática através do sangue e/ou neurônios para
órgãos-alvos.
As famílias de vírus nesse grupo são:
picornavirus;
vírus do
sarampo;
vírus da
caxumba;
vírus herpes simplex;
vírus da varicela;
vírus da
hepatite A e B
·
Infecção por agulhas ou
picadas de insetos, seguida de disseminação para órgãos-alvos:
Famílias de vírus neste grupo são
vírus da
hepatite B;
alphavirus; flavivirus; bunyavirus
A imunidade
local mediada pela IgA
é muito importante nas duas primeiras
categorias. Não faz sentido ter um bom anticorpo humoral neutralizante na
circulação quando o vírus se replica, por exemplo, no trato respiratório
superior. Aqui certamente anticorpos secretados serão importantes.
Assim, precisamos saber:
-
O(s) antígeno(s) viral (is) que
provoca(m) anticorpo neutralizante
-
O(s) antígeno(s) da superfície celular
que provoca(m) anticorpo neutralizante
-
O local de
replicação do vírus
|
| |
Tipos de
vacinas
Existem cinco tipos básicos de vacina em
uso hoje
-
Vacinas mortas: São preparações do vírus
infeccioso e patogênico normal (tipo selvagem) que se tornou não
patogênico, geralmente por tratamento químico, como com formalina que
faz reação cruzada com proteínas virais.
-
Vacinas atenuadas: São partículas de
vírus vivos que crescem na pessoa que recebe a vacina, mas não causam
doença porque o vírus da vacina foi alterado (mutado) para uma forma não
patogênica; por exemplo, seu tropismo foi alterado para que ele não
cresça mais em um local que possa causar doenças.
-
Vacinas de sub-unidades: São componentes
purificados do vírus, como um antígeno de superfície.
-
Vacinas
de DNA: Estes geralmente são vírus inofensivos em que um gene para um
antígeno protetor foi emendado. O antígeno protetor é então feito no
receptor da vacina para obter uma resposta imune
-
Vacinas de RNAm: Estas são a sequência
de codificação de RNA de um antígeno protetor (geralmente de superfície)
que é traduzido pelas células da pessoa vacinada após a injeção e
expresso na superfície das células transfectadas.
Problemas
no desenvolvimento de vacinas
Existem muitos problemas inerentes ao
desenvolvimento de uma boa vacina antiviral protetora. Entre eles estão:
-
Diferentes tipos de vírus podem causar
doenças semelhantes, por exemplo, o resfriado comum. Como resultado, uma
única vacina não será possível contra tal doença
-
Deriva antigênica e mudança - Isso é
especialmente verdade para
vírus de RNA
e aqueles com
genomas segmentados.
-
Grandes reservatórios de animais. Se
isso ocorrer, pode ocorrer reinfecção após a eliminação da população
humana
-
Integração do DNA viral. As vacinas não
funcionarão em virions latentes a menos que eles expressem antígenos na
superfície celular. Além disso, se o vírus da vacina se integrar aos
cromossomos de células hospedeiras, pode causar problemas (Este é, por
exemplo, um problema com o possível uso de
vacinas
anti-HIV
baseadas
em cepas de vírus atenuados)
-
Transmissão de célula para célula via
sincicial - Este é um problema para potenciais vacinas contra a AIDS,
uma vez que o vírus pode se espalhar de célula para célula sem que o
vírus entre na circulação.
-
Recombinação e mutação do vírus da
vacina em uma vacina atenuada.
Apesar desses problemas, as vacinas
antivirais têm sido, em alguns casos, espetacularmente bem sucedidas (ver
adendo)
levando em um caso (varíola) à eliminação da
doença da população humana. A vacina contra varíola é um exemplo de uma
vacina atenuada, embora não do vírus original da varíola patogênica. Outra
vacina bem sucedida é a vacina contra a poliomielite que pode levar à
eliminação dessa doença da população humana em breve. Esta vacina vem de
duas formas. A vacina salk é um vírus morto, enquanto a desenvolvida por
Albert Sabin é uma vacina contra o vírus atenuado vivo. A pólio está
atualmente restrita ao sul da Ásia (Paquistão e Afeganistão).
Embora a varíola seja a única doença
humana que foi erradicada usando vacinação, é provável que uma doença animal
também tenha sido erradicada. Rinderpest (peste bovina ou estepe murraína) é
uma doença viral com alta mortalidade que infecta bovinos e outros
ruminantes e causa febre, diarreia e necrose linfoide. É membro da família
do sarampo (Família:
Paramixoviridae;
Gênero: Morbillivirus) e foi erradicado
usando uma vacina atenuada viva. Em 2010, a Organização das Nações Unidas
para a Alimentação e a Agricultura informou que nenhum caso de rinderpest
havia sido diagnosticado há nove anos. É, portanto, a única doença da
pecuária agrícola que foi erradicada com sucesso.
|
 Figure 1b
Figure 1b
Mary Wortley Montague
The work of art depicted in this image
and the reproduction thereof are in the
public domain
worldwide. The reproduction is part of a
collection of reproductions compiled by The Yorck
Project. The compilation copyright is
held by
Zenodot Verlagsgesellschaft mbH
and licensed under the
GNU Free Documentation License. |
SUCESSOS
PASSADOS
Varíola (Bexiga)
A varíola é uma doença
devastadora e desfigurante que é altamente infecciosa. É causada
pelo vírus variola (também conhecido como vírus da bexiga), um
membro da ortopofoxviridae (figura 2A). A doença da varíola
é conhecida há milhares de anos e provavelmente se originou na Ásia.
Espalhou-se para o oeste no Oriente Médio e entre suas vítimas
estava o faraó Ramsés V (figura 2B). A doença pode ter chegado à
Europa com as cruzadas. A varíola foi introduzida no Novo Mundo por
colonos europeus e causou epidemias devastadoras na população
indígena que não tinha imunidade natural. De fato, alguns colonos
antigos usaram a varíola como arma biológica contra os habitantes
originais da América do Norte e do Sul.
A varíola é caracterizada por
numerosas pústulas contendo vírus infeccioso em todo o corpo (figura
2 C e D). A taxa de letalidade é de mais de um quarto dos pacientes
infectados pela forma mais grave causada pela Variola maior (varíola
clássica). Outra forma de varíola causada pela Varíola minor
(alastrim) tem uma taxa de fatalidade muito menor (até 5%).
As primeiras tentativas de
controle da varíola ocorreram no século X e usaram a variolação (assim
chamada porque o vírus da bexiga é Varíola). Na variolação (figura
2E), o material (cicatrizes) foi obtido a partir das pústulas de uma
pessoa infectada que não morreu da doença. Essa pessoa, portanto,
tinha uma forma mais branda de varíola como resultado de uma
variante natural. Este material foi usado para infectar outra pessoa
que geralmente também tem uma doença mais branda. Se a pessoa não
morreu, havia imunidade ao longo da vida. Outra razão para o
sucesso da variolação foi que o vírus nas cicatrizes era menos
virulento porque havia sido parcialmente dessecado e foi complexado
e inativado por anticorpos do doador.
A taxa de letalidade foi de cerca
de 1 a 2% e ainda era um procedimento perigoso. Esta técnica foi
usada no Paquistão, Etiópia e Afeganistão até 1970. Avariolação foi
generalizada na Inglaterra em 1700, onde foi introduzida pela esposa
do embaixador britânico na Turquia, Mary Wortley Montague (figura
1b).
.
|
|
Figura
2
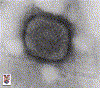
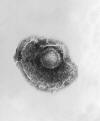
A. Vírus da varíola
Direitos autorais 1994 Divisão de Ciências Veterinárias
Queen's University Belfast
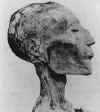 B. A cabeça mumificada de Ramsés V (morreu em 1157 A.C.) com erupção
cutânea que provavelmente é o resultado da varíola
B. A cabeça mumificada de Ramsés V (morreu em 1157 A.C.) com erupção
cutânea que provavelmente é o resultado da varíola
|
 C. Bebê com varíola
C. Bebê com varíola
 D. Lesões de varíola na pele
do tronco. Foto tirada em Bangladesh.
D. Lesões de varíola na pele
do tronco. Foto tirada em Bangladesh.
CDC/James Hicks
 E. Cicatrizes de varíola em pó foram inaladas para proteger contra varíola na
medicina chinesa
E. Cicatrizes de varíola em pó foram inaladas para proteger contra varíola na
medicina chinesa
|
| |
|
| Figura 3

A. Edward Jenner
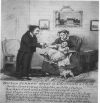 B. Dr Jenner prestes a vacinar uma criança
B. Dr Jenner prestes a vacinar uma criança |
 C. Blossom, a vaca
C. Blossom, a vaca
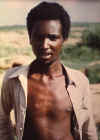 D. A última pessoa conhecida no mundo a ter um caso natural de
varíola. Variola menor em Ali Maow Maalin de 23 anos, Merka, Somália
D. A última pessoa conhecida no mundo a ter um caso natural de
varíola. Variola menor em Ali Maow Maalin de 23 anos, Merka, Somália
CDC
|
| |
Em 1796, Edward Jenner (figura 3A), que na época estava fazendo experiências
com variolação, descobriu a vacinação usando o vírus da vaccinia, o agente
da varíola bovina (vacca é o latim para vaca).
Jenner era um médico que vivia na zona rural de Gloucestershire, no oeste da
Inglaterra, e era amplamente conhecido naquela época que pessoas que
contraíam varíola (como empregadas leiteiras) pareciam ganhar imunidade
protetora contra a varíola muito mais virulenta. Jenner vacinou um Sr.
Phipps (que trabalhava para ele) e seu próprio filho (figura 3B) com varíola
de uma vaca chamada Blossom (figura 3C), e então os desafiou com varíola
virulenta. Ambos os vacinados foram, felizmente, protegidos. O vírus
original de Jenner não é o da vaccinia que foi usado em vacinas contra
varíola até recentemente. O vírus da vacina pode ter surgido como
recombinante de varíola de vaca ou varíola de cavalo. Por muito tempo, o
vírus da vacina foi mantido em cavalos ou búfalos.
O último caso de varíola natural no Reino Unido ocorreu na
década de 1930; o último nos EUA foi na década de 1940. O último caso
natural no mundo foi na Somália e ocorreu em outubro de 1977 (figura 3D).
Embora o vírus tenha sido eliminado na natureza, a varíola foi retida em
laboratórios e, como resultado de um acidente de laboratório, houve um caso
fatal em Birmingham, Inglaterra, em 1978, quando um fotógrafo médico morreu.
Essa pessoa foi a última pessoa a morrer de varíola no mundo.
Os estoques mundiais foram reduzidos a laboratórios nos
Estados Unidos e na União Soviética. Não se sabe se o vírus infeccioso do
laboratório russo foi distribuído após a dissolução da União Soviética.
A erradicação da varíola tem sido um dos grandes triunfos da
saúde pública. Há várias razões para isso:
-
Não há reservatório animal para variola, apenas humanos
são infectados por este vírus
-
Uma vez que uma pessoa foi infectada pelo vírus, há
imunidade ao longo da vida, embora este possa não ser o caso de pessoas
imunizadas usando a cepa de vacina
-
Casos subclínicos são raros e, portanto, uma pessoa
infectada pode ser identificada e isolada
-
A infectividade não precede sintomas exagerados, ou seja,
não há fase de incubação.
-
Há apenas um sorotipo Variola e, portanto, a vacina é
eficaz contra todas as cepas de vírus.
-
A vacina é muito eficaz.
-
Houve um grande compromisso da Organização Mundial da
Saúde e dos governos com a erradicação da varíola.
|
 Figura 4. Figura 4.
Louis Pasteur
 Figura 5.
Figura 5.
Vírus da raiva |
Raiva Quase um século
após o pioneirismo de Jenner sobre varíola, em 1885 Louis Pasteur (figura 4)
e Emile Roux desenvolveram a primeira vacina contra a raiva (figura 5) (rabhas,
sânscrito: para fazer violência). Pasteur descobriu que se ele pegasse
material da medula espinhal de um coelho morte que estava doente de raiva e
o mantinha por um período de 15 dias em uma atmosfera seca (um frasco
contendo hidróxido de potássio) e depois injetava em um cão, este último não
teve raiva. Ele desenvolveu um protocolo no qual realizou o mesmo
procedimento com tecido de medula que tinha sido mantido em uma atmosfera
seca por cada vez menos tempo (cada um foi separado por um intervalo de dois
dias), até que ele finalmente injetou tecido espinhal contendo vírus
virulento (apenas um dia ou dois no frasco). Ele descobriu que o cão tinha
ficado imune à raiva. Pasteur tratou com sucesso um menino (Joseph Meister)
mordido por um cão raivoso sessenta horas antes com este protocolo no qual
ele usou sucessivamente mais vírus virulento. De fato, segundo Pasteur, a
raiva na inoculação final foi mais virulenta do que a da raiva canina comum.
Felizmente, o menino Meister sobreviveu tanto às mordidas iniciais quanto ao
vírus virulento! As vacinas antirrábicas atuais não são preparadas da
maneira que Pasteur preparou. A Vacina Celular Diploide Humano (em inglês
HDCV) é feita em cultura de tecidos usando fibroblastos humanos normais
wi-38. O vírus da raiva é purificado por passagem através de um filtro e
inativado por beta-propriolactone. Esta vacina contra o vírus inativada é
usada quase exclusivamente no mundo desenvolvido para pré e pós-vacinação da
raiva. A Vacina de Embrião de Pinto Purificada, do inglês Purified Chick
Embryo Vaccine (PCEC) também é um vírus virulento purificado. É feito por
ultracentrifugação e inativado por beta-propriolactone. Essas vacinas dão um
alto título de anticorpos neutralizantes após 10 dias. Quando usados
corretamente, eles podem conferir 100% de proteção.
Há também uma vacina atenuada viva (cepa flury) que é cultivada em embriões
de pinto e é para uso apenas em animais.
Uma vacina antirrábica recombinante (VRG, Raboral) foi feita inserindo o
gene para a glicoproteína de superfície da raiva no vírus da vaccinia, o
vírus usado na vacina contra varíola. O vírus recombinado parece seguro para
humanos, mas é usado para tratar animais selvagens, já que (por ser um vírus
vivo) pode dar imunidade de rebanho. O vírus da vacina é estável a
temperaturas elevadas e pode ser administrado oralmente. É, portanto
administrado em animais como iscas alimentares. Raboral V-RG® é aprovado
para imunização de guaxinins e coiotes, dois dos mais significativos
portadores de raiva na América do Norte.
|
| |
|
|
|
Poliomielite
Nos países ocidentais, a
poliomielite do tipo selvagem
não é mais um problema, mas ainda é
endêmica no Paquistão e no Afeganistão (Figura 6). No entanto, o
poliovírus selvagem foi importado para alguns países que pararam a
transmissão de vírus indígenas e surtos podem resultar dessas
importações. Vários países continuam a ser afetados por tais surtos.
A maioria deles está no "cinturão de importação de poliovírus
selvagem" – vários países que se estendem da África Ocidental à
África Central e o Chifre da África (Figura 6).
Até a década de 1950, quando a
vacinação anti-pólio se tornou rotina, surtos de verão de
poliomielite eram comuns em países ocidentais, muitas vezes
espalhados pela rota oral-fecal enquanto usavam piscinas. Esses
surtos levaram à poliomielite paralítica generalizada que
necessitava de ajuda na respiração e no uso de "pulmões de ferro" (figura
7).
Vacinas anti-polio
Existem dois tipos de vacina
contra pólio, ambos desenvolvidos na década de 1950. O primeiro,
desenvolvido por Jonas Salk, é uma preparação de vírus normais
da poliomielite selvagem mortos por formalina. Eles são
cultivados em células renais de macaco e a vacina é dada por
injeção. Eles provocam uma boa imunidade humoral (IgG) e impedem
o transporte do vírus para os neurônios onde de outra forma
causariam poliomielite paralítica. Esta vacina é a única usada
em alguns países escandinavos onde eliminou completamente a
doença.
Uma segunda vacina foi
desenvolvida por Albert Sabin. Trata-se de uma vacina atenuada
viva que foi produzida empiricamente pela passagem serial do
vírus em culturas de células. Isso resultou na seleção de um
vírus mutante que cresceu bem na cultura e, de fato, no
intestino humano onde o vírus selvagem cresce. Não pode, no
entanto, migrar para os neurônios. Ele replica uma infecção
normal, uma vez que o vírus realmente cresce no vacinado e
provoca imunidade humoral e mediada por células. É dado
oralmente, uma rota que é tomada pelo vírus em uma infecção
normal, uma vez que o vírus é passado de humano para humano pela
rota oral-fecal. Esta se tornou a vacina preferida nos Estados
Unidos, Reino Unido e muitos outros países por causa da
facilidade de administração (muitas vezes em um bloco de açúcas
açúcar como um bombom.), o fato de que o vírus da vacina se
replica no intestino, e apenas uma administração é necessária
para obter uma boa imunidade (embora a administração repetida
tenha sido geralmente usada). Além disso, a imunidade resultante
da vacina Sabin dura muito mais tempo que pela vacina salk,
fazendo com que menos doses de reforço sejam necessárias. Uma
vez que provoca imunidade mucosa (IgA) no intestino (figura 10),
a vacina Sabin tem o potencial de eliminar o vírus tipo selvagem,
enquanto a vacina salk só impede que o vírus do tipo selvagem
entre nos neurônios.
A vacina sabin atenuada, no
entanto, veio com um problema: mutação retrógrada. Isso pode
resultar da recombinação entre o vírus do tipo selvagem e a cepa
da vacina. O vírus virulento é frequentemente isolado dos
receptores da vacina Sabin. Os casos residuais em países que
usaram a vacina contra o vírus vivo atenuado (cerca de 8 por ano
nos EUA até recentemente; figura 9a, b e c) resultaram da
mutação da cepa vacinal à virulência. Cerca de metade desses
casos foram em vacinados e metade em contatos dos vacinados. A
poliomielite paralítica surge em 1 em cada 100 casos de infecção
por vírus do tipo selvagem e 1 em 2,4 milhões de vacinas
iniciais como resultado da reversão da vacina à virulência. Isso
foi considerado aceitável, pois o uso do vírus atenuado
significa que a cepa vacinal do vírus ainda se replica no corpo
e dá imunidade intestinal via IgA.
O vacinado que recebeu a
vacina Salk morta ainda permite que o vírus tipo selvagem se
replique em seu trato gastro-intestinal, uma vez que a principal
resposta imune à vacina morta injetada é o IgG circulatório (figura
10). Como observado acima, esta vacina é protetora contra a
poliomielite paralítica, pois, embora o vírus do tipo selvagem
ainda possa se replicar no intestino da vacina, ele não pode se
mover para o sistema nervoso onde os sintomas da poliomielite se
manifestam. Assim, é improvável que o vírus do tipo selvagem
morra em populações que receberam apenas a vacina morta, uma vez
que seria eliminado pelas fezes. Deve-se notar, no entanto, que
estudos na Holanda durante um surto de poliomielite em 1992
(entre as pessoas que recusaram a vacina) mostraram que a
imunidade produzida pela vacina salk impediu a circulação de
vírus do tipo selvagem na população geral.
Um problema adicional do uso
de uma vacina atenuada viva é que as preparações podem conter
outros patógenos das células em que o vírus foi cultivado. Isso
certamente foi um problema inicialmente porque as células de
macaco usadas para produzir a vacina contra a poliomielite foram
infectadas com o
vírus símio 40 (SV40)
e isso também estava na vacina.
O SV40 é um vírus de polioma e tem potencial para causar câncer.
Parece, no entanto, não ter causado problemas nos vacinados que
o receberam inadvertidamente. Houve algumas alegações de que a
vacina original atenuada da poliomielite usada na África pode
ter sido contaminada com o vírus da
imunodeficiência humana
(HIV). Este não foi o
caso. Claro, também pode haver problemas semelhantes com a
vacina morta se ela for inativada incorretamente. Isso também
ocorreu.
Recomendações
atuais relativas às vacinas contra a poliomielite
Uma vez que os únicos casos
de pólio nos EUA estavam associados à vacina, a política
anterior de uso exclusivo da vacina Sabin foi reavaliada. No
início, ambas as vacinas foram recomendadas com a vacina morta
primeiro e depois a vacina atenuada. A vacina morta impediria os
revertentes da vacina viva que dão problemas ao migrarem para o
sistema nervoso. Assim, em 1997 foi recomendado o seguinte
protocolo:
Para reduzir os casos
associados à vacina (8 a 10 por ano), o Comitê Consultivo de
Práticas de Imunização (ACIP) do CDC recomendou (janeiro de
1997) um regime de duas doses injetáveis de vacina (inativadas:
Salk) seguidas de duas doses da vacina atenuada oral em um
calendário de 2 meses de idade (inativada), 4 meses (inativada),
12-18 meses (oral) e 4-6 anos (oral). Atualmente, quatro
doses da vacina oral são normalmente administradas nos dois
primeiros anos de vida. Acredita-se que o novo cronograma
eliminará a maioria dos casos de doença associada à vacina.
Este regime já foi adotado por vários países europeus e
alguns do Canadá.
O regime de vacinação contra
a pólio foi posteriormente alterado novamente em 2000:
Para eliminar o risco
de Poliomielite Paralítica Associada à vacina, a ACIP
recomendou um calendário de vacina contra poliovírus (IPV)
totalmente inativado para a vacinação de poliomielite
infantil de rotina nos Estados Unidos. A partir de 1º de
janeiro de 2000, todas as crianças devem receber quatro
doses de IPV com idades de 2 meses, 4 meses, 6 a 18 meses e
4-6 anos.
Em 2009, as recomendações
foram revisadas:
Três
vacinas combinadas diferentes contendo IPV foram licenciadas
para uso de rotina nos Estados Unidos. Devido à possível
confusão no uso de diferentes produtos vacinais para a
imunização de rotina e recuperação, a ACIP recomenda o
seguinte:
A série de IPV de 4 doses deve continuar a ser
administrada aos 2 meses, 4 meses, 6-18 meses e 4-6 anos.
A dose final na série IPV deve ser administrada aos ≥4
anos, independentemente do número de doses anteriores.
O intervalo mínimo da dose 3 para a dose 4 é estendido
de 4 semanas para 6 meses.
O intervalo mínimo da dose 1 à dose 2, e da dose 2 à
dose 3, permanece em 4 semanas.
A idade mínima para a dose 1 continua sendo de 6 semanas.
|
|
RELATO DE
CASO
Infecções por poliovírus em quatro crianças não vacinadas --- Minnesota,
agosto-outubro de 2005 |
|
Figura 6 – Estatística da Poliomielite Comparação da incidência mundial em
1988, 1998, 2004 e 2013
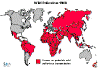 Polio - 1988 WHO
Polio - 1988 WHO
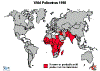 Polio - 1998 WHO
Polio - 1998 WHO
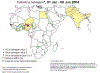 Polio - 2004
Polio - 2004
WHO
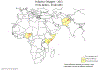 Polio - 2013
Polio - 2013
polioeradication.org
 Polio 2020
Polio 2020
Nosso Mundo em dados |
|
Figura 7 (à direita) - Poliomielite |
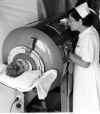 A. Criança em pulmão de ferro
A. Criança em pulmão de ferro
WHO
 B. Ala de pulmão de ferro
B. Ala de pulmão de ferro
 C.
Criança com sequelas de poliomielite
C.
Criança com sequelas de poliomielite
WHO
 D. Criança com sequelas de
poliomielite
D. Criança com sequelas de
poliomielite
WHO
 E. Vítimas da pólio
E. Vítimas da pólio
WHO
|
| |
|
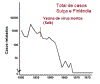 Figura 8
Figura 8
Total de casos notificados na Suécia e finlândia (1950-76) que usam a
vacina morta apenas desenvolvida por Jonas Salk. A vacina salk é
injetada.
|
 Figura 9a
Figura 9a
Casos relatados (casos por 100.000 habitantes) de poliomielite
paralítica nos Estados Unidos, 1951-1992, que inicialmente usou a vacina
salk morta. Esta foi posteriormente substituída pela vacina oral
atenuada viva desenvolvida por Albert Sabin. A vacina Sabin era
deglutida. Muitas vezes era dada com um pouco de açúcar.
 Figura 9b
Figura 9b
Poliomielite nos EUA 1980-1995
CDC
 Figura 9c
Figura 9c
Poliomielite paralítica associada à vacina - VAPP nos EUA 1964-1995
CDC
 Figura 10
Figura 10
Anticorpo secretório (IgA nasal e intestinal) e anticorpo do soro (IgG,
IgM e IgA do soro) em resposta à vacina contra pólio morta (esquerda)
administrada por injeção intramuscular e à vacina viva atenuada contra
poliomielite (direita) administrada oralmente.
|
| |
|
 Figura 10a Mortes por rotavírus global, 2013
Figura 10a Mortes por rotavírus global, 2013
OMS
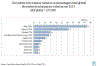 Figura 10b Países com o maior número de mortes por rotavírus em crianças
Figura 10b Países com o maior número de mortes por rotavírus em crianças
DA OMS
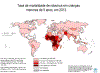 Figura 10c Mortalidade por Rotavírus em crianças menores de cinco anos
em 2013
Figura 10c Mortalidade por Rotavírus em crianças menores de cinco anos
em 2013
OMS
|
Doença
do rotavírus: Um problema inicial, mas sucesso depois
Rotavirus
são encontrados em todo o mundo e quase
todas as crianças no mundo são infectadas por rotavírus aos cinco anos
de idade. Esses vírus causam as principais internações por
gastroenterite e diarreia e mais de 215.000 mortes em 2013 em crianças
menores de cinco anos de idade. Em 2013, 37% dos óbitos em crianças
resultaram de diarreia (figura 10a). O vírus é espalhado pela rota oro-fecal.
Segundo a OMS, cinco países (Índia,
Nigéria, Paquistão, República Democrática do Congo e Angola) foram
responsáveis por mais da metade de todas as mortes por doenças rotavírus
em menores de cinco anos (figura 10b e c). Os sintomas incluem: febre,
vômito, diarreia e dor abdominal. Estudos de soroprevalência mostram que
o anticorpo está presente na maioria dos bebês aos 3 anos de idade.
Antes da introdução nos Estados
Unidos da vacinação generalizada em 2006, havia até três milhões de
casos de infecção por rotavírus por ano. Em cerca de 1 a 2,5% dos casos,
houve desidratação severa. Isso resultou em 20 a 60 mortes de crianças
menores de cinco anos a cada ano. Além disso, houve 50.000 a 70.000
internações e mais de 500.000 consultas a consultórios médicos por ano.
Desde a introdução da vacinação,
houve uma queda de até 86% nas internações relacionadas ao rotavírus.
É provável que a vacinação também
tenha protegido bebês não vacinados, limitando a infecção circulante. As
mortes também foram significativamente reduzidas. Em 2008, houve uma
estimativa de 14 mortes por doença rotavírus nos Estados Unidos e menos
de 10 no Reino Unido, em comparação com 98.621 na Índia.
Rotashield e
Intussuscepção
Vacinas
reassortantes
são criadas por
ressortimento genético no qual cepas de rotavírus não humanos
expressam os antígenos de rotavírus humanos em sua superfície. As
cepas não humanas se replicam, mas não causam doenças e são de baixa
patogenicidade em humanos. Uma vacina reassortante viva e
tetravalente rhesus-humana (Laboratórios Rotashield - Wyeth) foi
licenciada pela primeira vez para uso em bebês em agosto de 1998.
Continha os tipos G humanos 1, 2, 4 e símio G tipo 3. No entanto, a
vigilância pós-licença indicou uma possível relação entre a
ocorrência de intussuscepção de 3 a 20 dias após a administração da
vacina, com destaque para a primeira dose (foram notificados 15
casos/1,5 milhão de doses). Intussuscepção é uma obstrução
intestinal rara que ocorre quando o intestino se dobra sobre si
mesmo ou entra em si mesmo, resultando na redução do suprimento
sanguíneo. É mais comum entre crianças pequenas. O lugar mais comum
no intestino para a intussuscepção ocorrer é onde o intestino
delgado se junta ao cólon. No entanto, pode ocorrer em muitas partes
do intestino. Com tratamento rápido, quase todos os pacientes se
recuperam totalmente. É mais comum em meninos do que em meninas. O
uso da vacina Rotashield foi suspenso e acabou sendo retirada do
mercado em outubro de 1999, quando estudos confirmaram a ligação
entre vacinação e intussuscepção.
RotaTeq
RotaTeq (Merck) é uma vacina oral
viva licenciada nos Estados Unidos em 2006. Contém cinco
reassortantes (cepa de rotavírus bovino WC3 com proteínas
superficiais dos sorotipos humanos G1-4 e P1A). Não contém
conservantes ou timerosal. Três doses são dadas aos 2, 4 e 6 meses
de idade com a idade mínima para a primeira dose de 6 semanas. A
série não deve ser iniciada após 12 semanas. A eficácia da vacina
RotaTeq é elevada, com redução de 98% na gastroenterite por
rotavírus grave no primeiro ano de vacinação e redução de 96% na
taxa de internação. Há também uma redução de 74 e 71% da
gastroenterite por rotavírus no primeiro e segundo anos após a
vacinação.
Rotarix
Rotarix (Glaxo Smith Klein) é uma
vacina de rotavírus vivo atenuado que contém uma cepa de rotavírus
de especificidade G1P[8]. É utilizada para a prevenção da
gastroenterite por rotavírus causada pelos tipos G1 e não G1 (G3, G4
e G9) quando administrada como uma série de 2 doses em bebês e
crianças. Ambas as vacinas de rotavírus são muito eficazes (85% a
98%) na prevenção da gastroenterite associada à infecção e à
diarreia. O CDC recomenda a vacinação de rotina de bebês com
qualquer uma das duas vacinas disponíveis. Ambas são administradas
oralmente.
-
RotaTeq® (RV5). É dada em 3 doses com
idades de 2 meses, 4 meses e 6 meses
-
Rotarix® (RV1). É dada em 2 doses com
idades de 2 meses e 4 meses.
Outras vacinas incluem Rotavac (Índia),
Rotavin (Vietnã) e Langzhou Lamb (China).
|
| |
OUTRAS
VACINAS ANTI-VIRAIS
Há uma série de
outras vacinas antivirais comumente usadas e estas estão listadas
abaixo:
|
TABELA 1
Vacinas antivirais usadas atualmente |
|
Virus |
Tipo de vacina |
Micrografia
|
CDC Links |
|
Poliomielite (Salk) |
Inativada |
 Eletromicrografia de transmissão do poliovírus tipo 1.
Eletromicrografia de transmissão do poliovírus tipo 1.
CDC/Dr. Joseph J. Esposito jje1@cdc.gov |
Recomendações atualizadas do Comitê Consultivo sobre Práticas de Imunização
(ACIP) em relação à vacinação de rotina contra poliovírus (2009) |
|
Poliomielite (Sabin) |
Atenuada |
|
Raiva |
A vacina humana atual está inativada. Há uma vacina
atenuada para uso animal. |
Vírus da Raiva
Departamento de Saúde do Estado de Nova York
|
Recomendações da ACIP) um cronograma de vacinação reduzido (4 doses) para
profilaxia pós-exposição para prevenir a raiva humana (2008) |
|
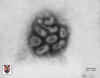
Caxumba |
Atenuada |
Vírus da caxumba
CDC PHIL
|
Utilização de vacinas combinadas contra sarampo, caxumba, rubéola e varicela
Recomendações do Comitê Consultivo de Práticas de Imunização (ACIP) |
|
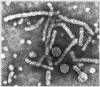
Sarampo |
Atenuada |

Vírus do Sarampo
CDC PHIL
|
|
Rubéola |
Atenuada |
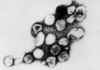
Vírus da rubéola
CDC PHIL |
|
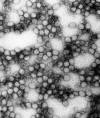
Gripe |
Inativada |
Direitos autorais do vírus da
influenza
1994 Divisão de Ciências Veterinárias Queen's University Belfast
|
Prevenção e Controle da Influenza com Vacinas: Recomendações do Comitê
Consultivo de Práticas de Imunização (ACIP), 2011
|
|
Hepatite A |
Inativada |
|
Prevenção da Hepatite A através da imunização ativa ou passiva.
Recomendações do Comitê Consultivo de Práticas de Imunização (ACIP), 2006
|
|
Hepatite B |
Subunit |
Virus da Hepatite B
Copyright Dr. Linda M Stannard, Universidade da Cidade do Cabo, África do Sul,
1995.
|
Vacina da
hepatite B Recomendações (2005, 2006, e 2011)
Parte 1 - Bebês, Crianças e Adolescentes
Parte 2 - Adultos |
|
Varicella |
Atenuada |

Vírus da Varicela
John Curtin School of Medical Research Australian National University Canberra,
Austrália. Micrografo: Dr. Frank Fenner
|
Prevenção da Varicela Recomendações do Comitê Consultivo de Práticas de
Imunização (ACIP), 2007
|
|
Rotavirus |
Atenuada |

Rotavirus
Direitos autorais1994 Divisão de Ciências Veterinárias, Queen's
University, Belfast
|
Prevenção da Gastroenterite por Rotavírus Entre Bebês e Crianças
Recomendações do Comitê Consultivo de Práticas de Imunização (ACIP),
Rotavírus e Intussusception 2009
|
|
Febre Amarela |
Atenuada |
Vírus da febre amarela
CDC PHIL
|
Vacinas contra febre amarela Reconseendas do Comitê Consultivo de Práticas
de Imunização (ACIP), 2010
|
|
Papiloma Humano |
Subunit |
|
Recomendações de vacina contra papilomavírus humano quadrivalentes do Comitê
Consultivo de Práticas de Imunização (ACIP), 2007
|
|
Encefalite japonesa |
Inativada |
|
Vacinas de Encefalite japonesa Recomendadas pelo Comitê Consultivo de
Práticas de Imunização (ACIP), 2010
|
Varicela
|
Atenuada |
Varicela (Vírus da Varicela)
CDC PHIL
|
Prevenção da Varicela. Recomendações do Comitê Consultivo de Práticas de
Imunização (ACIP), 2007
|
|
Herpes Zoster |
Atenuada |
|
Prevenção de Herpes Zoster. Recomendações do Comitê Consultivo de Práticas
de Imunização (ACIP), 2008
|
Para obter mais informações sobre vacinas anti-HIV (AIDS) acesse
aqui
|
|
|
|
| |
VACINAS MORTAS
VERSUS VACINAS ATENUADAS
Vacinas atenuadas
A
atenuação é geralmente alcançada pela passagem do vírus em outros
hospedeiros estranhos, como ovos galados ou células de cultura de tecidos.
Dentre os vários vírus mutantes que existem em uma população (especialmente
em vírus de RNA), alguns serão selecionados que têm uma melhor capacidade de
crescer no hospedeiro estranho (maior virulência). Estes tendem a ser menos
virulentos para o hospedeiro original. Para produzir a vacina de
poliomielite Sabin, a atenuação só foi alcançada com um grande inóculo e
rápida passagem em células renais de macaco primário. A população de vírus
tornou-se supercrescida com uma cepa menos virulenta (para humanos) que
poderia crescer bem em tecido não nervoso (rim), mas não no sistema nervoso
central. Cepas não virulentas dos três tipos de poliomielite foram
produzidas para a vacina.
Base molecular de atenuação
Não
sabemos a base da atenuação na maioria dos casos, uma vez que a atenuação
foi alcançada empiricamente. O método de passagem empírica em células
estrangeiras causa muitas mutações em um vírus e é difícil determinar quais
são as mutações importantes. Muitos vírus atenuados são sensíveis à
temperatura (ou seja, crescem melhor a 32 - 35 graus do que 37 graus) ou
adaptados ao frio (eles podem crescer a temperaturas baixas de 25 graus). Na
cepa de vacina atenuada do vírus da poliomielite tipo 1, há 57 alterações de
nucleotídeos no genoma, resultando em 21 alterações de aminoácidos. Um terço
das mutações estão no gene VP1 (este gene é apenas 12% do genoma). Isso
sugere que a atenuação resulta de mudanças nas proteínas superficiais do
vírus
Uman vacina nasal atenuada para
influenza
(FluMist®)
foi desenvolvida (veja abaixo). Esta
contém cepas de vacinas adaptadas a frio do vírus da gripe que foram
semeadas em cultura de tecidos a temperaturas progressivamente mais baixas.
Após uma dúzia ou mais dessas passagens, o vírus cresce bem apenas em torno
de 25° e o crescimento in vivo é restrito ao trato respiratório
superior. Estudos mostraram que a doença da gripe ocorreu em apenas 7% dos
voluntários que receberam a vacina contra a gripe intra-nasal, contra 13%
injetados com vacina contra gripe inativada trivalente e 45% dos voluntários
que receberam placebo. Ambas as comparações de vacinas com placebo foram
estatisticamente significativas.
|
| |
Vantagens das vacinas
atenuadas
-
Elas ativam todas as fases do sistema imune. Eles
provocam IgG humoral e IgA local (figura 8)
-
Elas montam uma resposta imune contra todos os antígenos
protetores. A inativação, como por formaldeído no caso da vacina Salk,
pode alterar a antigenicidade
-
Elas oferecem imunidade mais durável e com mais reações
cruzadas. Assim, estimulam anticorpos contra múltiplos epítopos que são
semelhantes aos provocados pelo vírus do tipo selvagem
-
Elas custam menos para produzir
-
Elas dão imunidade rápida na maioria dos vacinados
-
Em muitos casos (por exemplo, vacinas contra
poliomielite e adenovírus), a administração é fácil
-
Essas vacinas são facilmente transportadas no campo
-
Elas podem levar à eliminação do vírus tipo selvagem da
comunidade
Desvantagens da vacina atenuada
-
Mutação. Isso pode levar à reversão à virulência (esta é
uma grande desvantagem)
-
Espalha-se para contatos do vacinado que não consetiu
ser vacinado (Isso também pode ser uma vantagem nas comunidades onde a
vacinação não é 100%)
-
Disseminação do vírus da vacina que não é padronizado e
pode ser mutado
-
Às vezes há pobre "vacinação" nos trópicos
-
Vírus vivos são um problema em pacientes com doenças de
imunodeficiência.
|
| |
Vantagens da vacina
inativada
-
Elas fornecem imunidade humoral suficiente se for dado
um refôrço
-
Não há mutação ou reversão (Isto é uma grande vantagem)
-
Elas podem ser usadas com pacientes imunodeficientes
-
Às vezes elas funcionam melhor em áreas tropicais
Desvantagens das Vacinas Inativadas
-
Algumas vacinas não montam uma imunidade
-
Reforços tendem a ser necessários
-
Há pouca imunidade de mucosa/local (IgA). Isso é
importante (figura 8)
-
Custo mais alto
-
No caso da poliomielite, há uma escassez de macacos
-
No caso da varíola, houve falhas na inativação que
levaram à imunização com vírus virulento.
|
 Figura 11 Cepa de vacina atenuada contra influenza usando um mutante
sensível ao frio que pode ser ressortido com novas cepas virulentas Figura 11 Cepa de vacina atenuada contra influenza usando um mutante
sensível ao frio que pode ser ressortido com novas cepas virulentas |
NOVOS MÉTODOS DE PRODUÇÃO DE VACINAS
Seleção de
mutantes de sentido alterado
Mutantes letais condicionais.
Mutantes sensíveis à temperatura na Influenza A e RSV foram produzidas por
mutação com 5 fluorouracil e depois selecionados para sensibilidade à
temperatura. No caso da influenza, o gene sensível à temperatura pode ser
ressortido em laboratório para produzir uma cepa de vírus com a capa de
linhagens que circulam na população e com as proteínas internas da linhagem
atenuada. Mutantes adaptados ao frio também podem ser produzidos desta
forma. Foi possível obter mutações de sentido alterado em todos os seis
genes para proteínas não superficiais.
A vacina atenuada contra influenza,
chamada de FluMist, usa um mutante sensível ao frio que pode ser ressortido
com qualquer nova cepa de influenza virulenta que apareça (figura 11). O
vírus ressortido terá os genes das proteínas internas do vírus atenuado (e,
portanto, será atenuado), mas exibirá as proteínas de superfície da nova
variante antigênica virulenta. Como isso se baseia em um vírus vivo e
atenuado, a personalização da vacina para as novas variantes de gripe de
cada ano é muito mais rápida do que o processo de prever quais cepas de
influenza serão importantes para a próxima temporada de doença e combiná-las
em uma vacina morta.
|
| |
Peptídeos sintéticos
Os peptídeos injetados que são muito menores do que a proteína
original do vírus montam uma resposta IgG, mas há um problema com a
baixa antigenicidade. Isso porque o epítope pode depender da
conformação da proteína no vírus como um todo. Um exemplo não viral
que alcançou algum sucesso limitado é um protótipo de vacina
antimalária.
|


 Figura 12 Anticorpos anti-idiotipo
Figura 12 Anticorpos anti-idiotipo |
Vacinas anti-idiotipo
Um sítio de ligação ao antígeno em um anticorpo é um reflexo da
estrutura tridimensional da parte do antígeno, que é de um epítopo
em particular. Esta estrutura única de aminoácidos no anticorpo é
conhecida como idiotipo que pode ser considerado como um espelho do
epítopo no antígeno. Anticorpos (anti-idiotipos) podem ser montados
contra o idiotipo injetando o anticorpo em outro animal. Isso nos dá
um anticorpo anti-idiotipo e isso, portanto, imita parte da
estrutura tridimensional do antígeno, ou seja, o epítopo (figura
12). Isso pode ser usado como vacina. Quando o anticorpo anti-idiotipo
é injetado em uma pessoa que recebe a vacina, anticorpos (anticorpos
anti-anti-idiotipo) são formados, que reconhecem uma estrutura
semelhante a parte do vírus e poderiam potencialmente neutralizar o
vírus. Isso acontece: anticorpos anti-idiotipos produzidos contra
anticorpos dirigidos ao antígeno S da hepatite B montam anticorpos
antivirais.
|
| |
Técnicas de
DNA recombinante
Atenuação de virus
Mutações por deleção podem ser provocadas, que são grandes o suficiente
para que sejam improváveis de reverter (embora a supressão da mutação
continue sendo um problema. Isso tem sido visto em alguns dos mutantes
de deleção Nef desenvolvidos como potenciais vacinas anti-HIV).
Outro problema dessa abordagem em algumas vacinas é que o vírus ainda
pode reter outras características indesejadas, como a oncogenicidade
(por exemplo, com adenovírus, vírus herpes, HIV).
Abordagem por único gene
(geralmente gene de uma glicoproteína de superfície do vírus)
Um único
gene (para um antígeno protetor) pode ser expresso em um hospedeiro
estranho. Vetores de expressão são usados para fazer grandes quantidades
de antígeno para serem usados como vacina. O gene poderia ser expresso e
a proteína purificada de bactérias usando um processo de fermentação,
embora a falta de processamento pós-tradução pela bactéria seja um
problema. Leveduras são melhores para fazer grandes quantidades de
antígeno para vacinas, uma vez que processam glicoproteínas em seus
corpúsculos Golgi de uma maneira mais semelhante aos mamíferos. Um
exemplo de uma vacina na qual uma proteína viral é expressa e purificada
de levedura é Gardasil, uma vacina anti-papiloma vírus humano que é
muito eficaz na prevenção do câncer cervical. A atual vacina contra
hepatite B também é desse tipo. Uma vacina anti-papiloma vírus humano
semelhante, Cervarix, é produzida pela expressão de genes virais
recombinados em um baculovírus e expressados em células de insetos.
A
expressão da proteína S do SARS-CoV-2 no bacculovírus também é usada na
preparação da vacina Novavax COVID-19 (veja abaixo) que tem se mostrado
altamente eficaz, possivelmente devido ao uso de um adjuvante
proprietário eficaz.
Essas
vacinas têm muitas das desvantagens de uma vacina morta. Esta abordagem
tem sido usada para fazer várias vacinas potenciais contra o HIV, mas
elas montam pouca imunidade mediada por células.
Clonagem de um gene em outro vírus
Clonando o gene para um antígeno protetor em diferentes vírus
inofensivos, o antígeno é apresentado assim como no vírus original. Além
disso, as células ficam infectadas, levando à imunidade mediada por
células. O vaccinia (o vírus da vacina contra varíola) é um bom
candidato, uma vez que tem sido amplamente utilizado na população humana
sem efeitos nocivos. Além disso, uma cepa multivalente do vírus da
vacina pode ser feita desta forma, pois a vaccinia aceitará vários genes
estranhos. Uma vacina contra HIV candidata foi submetida a testes
clínicos. No entanto, o uso do vaccinia contra a varíola tem mostrado
complicações raras, mas graves, em pacientes imunocomprometidos e
alternativas têm sido procuradas. Um deles é um vírus da bexiga dos
canários recombinante que não se replica em humanos, mas infecta
células. A imunização com vetor recombinante vivo do vírus da bexiga dos
canários expressando o gene do envelope do HIV induziu uma resposta CTL
específica contra o HIV-1. Construtos similares como gag, protease, nef
e partes de genes pol têm sido estudados em ensaios clínicos, mas todos,
até agora, não mostraram eficácia clínica.
Hoje, o
vetor de vírus mais utilizado é um adenovírus humano ou de chimpanzé
modificado que foram usados em várias vacinas COVID-19.
|
| |
VACINAS DE DNA Essas
vacinas são baseadas na introdução de um plasmídeo de DNA ou vírus inteiro no
vacinado. A vacina carrega um gene codificador de proteínas extra que expressa
um antígeno que causa uma resposta imune; por exemplo, algumas vacinas COVID-19
usam um adenovírus deficiente em replicação expressando a proteína S do
SARS-CoV-2.
Essas vacinas são frequentemente chamadas de
vacinas de DNA, mas seria melhor serem chamadas de imunização mediada pelo DNA
ou baseada em DNA, já que o propósito não é produzir anticorpos contra as
moléculas de DNA em si, mas obter a proteína expressa pelas células da vacina.
Normalmente, as células musculares fazem isso já que o DNA é injetado via
intramuscular.
|
|
RECURSOS WEB
Vacinas de DNA da web
|
| |
Vantagens das vacinas
de DNA
-
Plasmídeos ou vírus de DNA são facilmente fabricados em
grandes quantidades
-
DNA é muito estável
-
DNA resiste a temperaturas extremas e assim o
armazenamento e o transporte não têm problema.
-
Uma sequência de DNA pode ser mudada facilmente em
laboratório. Isso significa que podemos responder rapidamente às
variantes do agente infeccioso. Isso tornou-se particularmente
importante no desenvolvimento de vacinas contra o COVID-19.
-
Ao usar DNA injetado na vacina com a codificação para a
síntese de antígenos, as proteínas antigênicas que são produzidas são
processadas (por modificações pós-tradução) da mesma forma que as
proteínas do vírus contra as quais a proteção deve ser produzida. Isso
faz um antígeno muito melhor do que, por exemplo, usando um plasmídeo
recombinante para produzir um antígeno na levedura (por exemplo, a
vacina HBV), purificando essa proteína e usando-a como um imunógeno.
-
Misturas de construtos de DNA poderiam ser usadas que
codificariam para muitos fragmentos de proteína de um ou mais vírus, de
forma que pudesse ser produzida uma vacina de amplo espectro
-
O construto de DNA não se replica no vacinado e codifica
apenas para as proteínas de interesse
-
Devido à forma como o antígeno é apresentado, há uma
resposta mediada por células que pode ser direcionada contra qualquer
antígeno no patógeno. Isso também oferece proteção contra doenças
causadas por certos patógenos intracelulares obrigatórios (por exemplo,
Mycobacterium tuberculosis)
Tudo isso significa que as vacinas de DNA são baratas e,
portanto, provavelmente serão desenvolvidas contra patógenos de menor
importância econômica (pelo menos para as empresas farmacêuticas)
|
| |
Problemas Possíveis
-
Potencial integração do DNA no genoma hospedeiro levando
à mutagênese por adição
-
Indução de respostas autoimunes (por exemplo, anticorpos
anti-DNA patogênicos)
-
Indução da tolerância imunológica (por exemplo, onde a
expressão do antígeno no hospedeiro pode levar a uma não-responsividade
específica a esse antígeno)
|
| |
A vacina atual contra a influenza é uma
preparação inativada contendo antígenos das cepas de influenza que são
previstas para infectar durante a próxima temporada da doença. Se tal
previsão der errado, a vacina é de pouca utilidade. São os antígenos de
superfície que mudam como resultado do ressortimento do vírus no
reservatório animal (pato)
(ver
influenza).
A vacina é injetada
intramuscularmente e provoca uma resposta IgG (anticorpo humoral na
circulação). A vacina é protetora porque IgG suficiente atravessa a mucosa
dos pulmões onde pode ligar e neutralizar o vírus que entra ligando a
antígenos de superfície. Se for utilizada uma vacina de DNA, são produzidos
linfócitos T humorais e citotóxicos (CTL), que reconhecem antígenos
apresentados por células transfectadas por vacinas. As CTLs são produzidas
porque as células musculares infectadas apresentam antígenos de influenza em
associação com as moléculas da classe I do MHC. Se o antígeno apresentado é
a proteína do nucleocapsídeo (que é uma proteína conservada), isso supera o
problema da variação antigênica. Tal abordagem poderia revolucionar a vacina
contra a influenza.
Outros estudos têm usado uma mistura de
plasmídeos codificando tanto nucleoproteína quanto antígenos de superfície.
A proteção por vacinas de DNA também foi demonstrada com raiva, micoplasma e
Plasmodium yoelii. Vacinas anti-HIV também estão sendo testadas. Nos
capítulos do
HIV,
observou-se que o
progresso nas vacinas contra a AIDS tem sido prejudicado pelo fato de que
muitas vacinas só provocam anticorpos humorais, enquanto o uso de vacinas
contra vírus inteiros (que poderiam provocar respostas CTL) foi rejeitado
por causa de outros problemas potenciais. Vacinas à base de plasmídeos podem
superar esses problemas.
VACINAS DE DNA
À BASE DE ADENOVÍRUS
AstraZenica/Oxford University Vaccine: AZD1222, CHADOX1 NCOV-19
A vacina ChAdOx1 nCoV-19 (AZD1222)
consiste no vetor de adenovírus símio deficiente em replicação ChAdOx1,
contendo o gene da glicoproteína S de comprimento completo do SARS-CoV-2,
com uma sequência de líder de ativação de plasminogênio tecidual. O ChAdOx1
nCoV-19 expressa sequência codificadora para a proteína S com códon
optimizado. Um adenovírus símio em vez de humano é usado porque o uso de
adenovírus humano é limitado pela imunidade pré-existente ao vírus dentro da
população humana que reduz significativamente a imunogenicidade das vacinas
baseadas no vírus humano. Isto não é um problema com o vírus símio porque,
embora os adenovírus símios estejam intimamente relacionados com os
adenovírus humanos, as regiões hipervariáveis do imunógeno principal são
significativamente diferentes do vírus humano, evitando assim a imunidade
pré-existente.
Os vetores de adenovírus símios não
possuem a região E1 que codifica para proteínas transativadoras virais que
são essenciais para a replicação de vírus e para a região E3 codificando
para proteínas imunomodulatórias. Esta última deleção permite a incorporação
de sequências genéticas maiores no vetor viral.
O adenovírus da vacina é tomado pelas
células e é transcrito no núcleo para fazer RNAm que é traduzido para a
proteína S.
A eficácia é de até 90%, dependendo da
dosagem. Maior eficácia foi encontrada em um subgrupo no qual a primeira de
duas doses foi reduzida pela metade. A eficácia média foi de 70,4%.
AD5-NCOV, Convidicea (Cansino Biologics, China)
Esta é outra vacina à base de adenovírus.
Baseia-se no vetor de adenovírus humano tipo 5 recombinante deficiente na
replicação para induzir uma resposta imune. Mais uma vez, o vírus foi
tornado deficiente de replicação pela deleção dos genes E1 e E3. Ele tem
codificação para uma proteína S de tamanho completo baseado na sequência do
vírus Wuhan-Hu-1 com o gene de peptídeo de sinal ativador de plasminogênio
tissular.
GAM-COVID-VAC, Sputnick V (Instituto de Pesquisa de Epidemiologia e
Microbiologia de Gamaleya, Rússia)
Gam-COVID-Vac é uma vacina de dois
vetores baseada em dois adenovírus humanos modificados contendo o gene que
codifica para a proteína S de SARS-CoV-2. A primeira inoculação usa
adenovírus 26 (Ad26) como vetor do gene da proteína S, enquanto a segunda
usa adenovírus 5 (Ad5). Esta vacina foi mostrada em janeiro de 2021, com
91,6% de eficácia contra o Covid-19 sintomático.
AD26. COV2.
S, JNJ-78436735 (Janssen/Johnson e Johnson, Estados Unidos e Bélgica)
Esta vacina é também baseada em um
vetor de adenovírus modificado recombinante. Como a vacina Sputnick, ela usa
ad26 humana expressando a proteína S, neste caso em uma única inoculação.
Ela monta a produção de um forte anticorpo neutralizador e resposta mediada
por células. Ela usa a tecnologia AdVac que aumenta a estabilidade
para que a vacina possa ser armazenada a temperaturas de geladeira por pelo
menos três meses.
VACINAS de
RNAm
As duas primeiras vacinas para COVID-19
aprovadas no final de 2020 foram baseadas em um protocolo no qual a codificação
do RNAm para o antígeno de interesse envolvida por um portador lipídico (nanopartícula
lipídica) é injetada na pessoa vacinada. O lipídio protege o RNAm das
ribonucleases e facilita sua entrada nas células. O RNAm é traduzido a proteína,
processado e apresentado ao sistema imunológico da maneira usual. A proteína de
interesse é geralmente aquela que se liga ao receptor celular e anticorpos a
essa proteína que bloqueiam a interação receptor celular-vírus evitará a
infecção e são chamados de anticorpos neutralizantes. No caso das vacinas contra
SARS-CoV-2, este é o antígeno S que se liga ao receptor ACE2 humano.
Um grande problema com as vacinas mRNA é sua
estabilidade no trânsito a partir do local de fabricação, fora da célula no
local da injeção e dentro da célula. O DNA é inerentemente estável dentro da
célula, pois deve passar o código genético de célula para célula indefinidamente.
Em contraste, os RNAm têm uma vida muito curta em comparação com o DNA. A
quantidade de um RNAm depende do equilíbrio entre a taxa de síntese e a taxa de
degradação. Muitas proteínas são necessárias apenas por um tempo muito curto, e
se seus RNAm fossem muito estáveis o nível de proteínas não poderia ser
controlado. Assim, embora todos os RNAm tenham vida curta, muitos são degradados
muito rapidamente após a tradução, facilitando respostas rápidas às condições da
célula. Os RNAm são degradados por ribonucleases (RNAses). Diferentes RNAm têm
diferentes graus de estabilidade resultantes de sua estrutura secundária e da
natureza das extremidades da molécula. Estas são conhecidas como elementos cis.
Além disso, sua estabilidade também é regulada por fatores de ligação a RNA ou
elementos trans. Os elementos cis incluem a cauda 3' poli A e a 5’ metil
guanosina (5’Cap). A cauda 3' poli A se liga a proteínas ligadoras a poli-A que
estabilizam o RNA. Essas proteínas requerem um certo comprimento de cauda poli A
para se ligarem e assim quanto maior a cauda poli A, mais dessas proteínas podem
se ligar ao RNA. O RNAm é degradado do final de 3' por exonucleases de 3'-5' e
no final de 5' pela remoção do 5’ Cap e pela ação exonucleásica 5'-3'. A
atividade endonucleásica também degrada o RNAm e isso pode ser regulado por
outras proteínas de ligação a RNA. Sequências ricas em AU na região não
traduzida (UTR) de 3' também estão envolvidas na estabilidade.
RNAm
também pode ser estabilizado por modificação química das bases do ácido nucleico
por si só. Tais modificações incluem metil-adenosina, N-1-metilpseudouridina e
pseudouridina (feita de uridina pela pseudouridina-sintetase (figura 13), uma
modificação de base que é comum no RNAt e aumenta sua estabilidade. No RNAm,
essas bases substituídas melhoram a tradução. Pseudouridina e
N-1-metilpseudouridina reprimem gatilhos de sinalização intracelular para
ativação da proteína cinase R que está envolvida na estabilidade do RNAm. É
claro que tais modificações não devem alterar a fidelidade da tradução da
mensagem.
As vacinas de RNAm são feitas pela
transcrição de uma proteína codificada em um plasmídio reconhecida por um
anticorpo neutralizante, no caso de uma vacina Covid-19, esta é a proteína S. O
plasmídeo, que contém as sequências de promotores apropriadas, é linearizado e
transcrito in vitro usando uma RNA polimerase de fago T7, T3 ou Sp6. O produto
resultante contém uma fase de leitura aberta que codifica para a proteína S
ladeada por UTRs 5' e 3', uma 5' metil guanina Cap e uma cauda poli A. Isto é o
que é usado como vacina.
A Figura 14 mostra uma maneira de isso ser
feito em um sistema da AmpTec. O gene da proteína S é clonado em um local de
inserção em um plasmídeo m13 junto com um promotor T7 (A). Um primer sentido
complementar ao final da sequência M13 (Pri) e um segundo primer reverso
complementar ao final do gene S são usados (B). Este último primer inclui uma
sequência poly T, geralmente em torno de 120 nucleotídeos que não hibridiza com
qualquer sequência m13. Utilizando PCR, a estrutura de DNA mostrada em C é
produzida. Esta é então usada na transcrição in vitro do promotor T7 para
formar o RNAm poliadenilado mostrado em D. A transcrição in vitro pode
ser realizada na presença de nucleotídeos modificados, como pseudouracil e/ou
N6-metil adenosina, 5-metil citidina e outros. Estes RNAm modificados são muito
mais estáveis do que os RNAm normais e são altamente traduzíveis dando à vacina
uma eficácia muito maior.
A proteína resultante é processada da maneira
normal através da via exócítica com todas as modificações pós-tradução usuais,
incluindo glicosilação e transportada para a superfície celular. Como descrito
acima, a proteína também pode ser clivada por proteases para formar pequenos
peptídeos que podem ser apresentados na superfície das células ao sistema
imunológico. A célula possui mecanismos antivirais para detectar e degradar RNAs
estranhos e medidas são tomadas para minimizar isso.
Mesmo com modificações de nucleotídeos, é
provável que o RNAm nu seja rapidamente degradado quando injetado na pessoa
vacinada. Além disso, o RNAm deve atravessar a membrana celular para ter acesso
à máquinária de tradução à proteínas da célula. Ambos os problemas podem ser
resolvidos encapsulando o RNAm em um envelope lipídico (uma nanopartícula
lipídica ou liposoma) que ajuda a vacina de RNAm a entrar no citoplasma ao sair
do endosomo antes de ser degradado no lisossomo.
As vacinas iniciais de RNAm contra o Covid da
BioNtec e Moderna usam uma tecnologia semelhante à anterior. Uma modificação que
pode muito bem ser usada em futuras vacinas de RNAm é fazer uma vacina de RNAm
que contenha não apenas RNAm para a proteína de escolha (por exemplo, a proteína
S do SARS-CoV-2), mas também RNAm para uma RNA polimerase dependente de RNA (replicase)
viral. Quando este tipo de vacina de RNAm for injetado em uma pessoa e entrar em
uma célula, ela será traduzida à proteína S e à replicase (que pode ser
codificada no mesmo RNAm ou em um segundo RNAm). A replicase viral pode
reconhecer sinais de replicação virais incluídos nos RNAm da vacina e pode então
amplificar o impacto da vacina de RNA, fazendo mais cópias do RNAm e, portanto,
mais da proteína. Uma vez que agora há mais da vacina RNAm na célula do que foi
originalmente entregue ao citoplasma, isso é conhecido como a abordagem auto
amplificadora (do inglês Self-amplifying, SA) do RNAm.
Tozinameran
(BNT162B2. Nome da marca: Comirnaty) Vacina Pfizer-BioNTech Covid-19
Tozinameran foi a primeira vacina RNAm a
ser aprovada. Em ensaios clínicos sua eficácia é de cerca de 95%, 28 dias
após a primeira dose e é bem tolerada. Em um dos ensaios iniciais, houve 170
casos confirmados de Covid-19, dos quais 162 estavam no grupo placebo e
apenas 8 no grupo vacinal. É dado em duas doses, com três semanas de
diferença. Não foi avaliada para infecção assintomática. Parece ser eficaz
contra as variantes descritas acima. Esta vacina deve ser armazenada e
transportada a -70 C.
Contém (Programa de nomes não
proprietários da OMS):
Uma estrutura modificada de 5'-cap1
(m7G+m3'-5'-ppp-5'-Am)
Regão 5'-não-traduzida derivada do RNA da
alfa-globina humana com uma sequência Kozak otimizada. Esta última garante
que a proteína seja corretamente traduzida pelo ribossomo e funcione como o
local de iniciação da tradução na maioria dos RNAm eucariotas.
O peptídio sinal da glicoproteína S para
direcionar o complexo nascente proteína/ribossomo para o receptor de sinal
na superfície citoplasmática da membrana do retículo endoplasmático rugoso.
Este guia a translocação da proteína para a orientação correeta no retículo
endoplasmático.
A sequência com códons optimizados que
codifica para a proteína S completa do SARS-CoV2 , contém duas mutações:
K986P e V987P. Estas alteram o dobramento da proteína S de modo que ela
adote uma conformação pré-fusão antigenicamente ideal. Todas as uridinas são
substituídas por resíduos de 1-metil-3'-pseudouridina (Ψ) (figura 15) que
são, no entanto, traduzidos eficientemente.
No final da sequência de codificação
estão dois Códons de parada ΨGA.
A região não traduzida de 3' compreende
dois elementos de sequência que conferem estabilidade ao RNA e alta
expressão proteica.
Uma cauda poli-A de 110 nucleotídeos
consistindo em um trecho de 30 resíduos de adenosina, seguido por uma
sequência linker de 10 nucleotídeos e outros 70 resíduos de adenosina.
Além disso, a vacina contém lipídios que
compõem as nanopartículas lipídicas sólidas que encapsulam o RNAm (ALC-0315
= ((4-hidroxibutil)azanediil)bis(hexano-6,1-diil)bis(2-hexildecanoato);
ALC-0159 = 2-[(polietileno glicol)-2000]-N,N-ditetradecylacetamida;
1,2-Distearoil-sn-gliceo-3-fosfocolina; e colesterol. Além disso, a vacina
contém água, sacarose, fosfato de sódio dibásico desidratado, fosfato de
potássio monobásico, cloreto de potássio e cloreto de sódio.
Vacina
Moderna. RNA1273m
A vacina Moderna também é um RNAm
consistindo em uma mensagem sintética que codifica a glicoproteína de
pré-fusão estabilizada da espícula do vírus SARS-CoV-2. A estabilização da
pré-fusão é alcançada pela substituição de duas prolinas como na vacina
BioNTech.
Mais uma vez, o RNAm é feito por
transcrição de um promotor T7 em uma reação na qual a UTP foi substituída
por 1-metilpseudoUTP. Além do RNAm, a vacina contém lipídios para formar uma
nanopartícula lipídica: (SM-102,
1,2-dimiristoil-rac-gliceo3-metoxipolietileno glicol-2000 [PEG2000-DMG],
colesterol, e 1,2-distearoil-snglicero-3-fosfocolina) e, trometamina,
cloridrato trometamina, ácido acético, acetato de sódio, sacarose e água.
A eficácia do 1273m é de cerca de 94,1%,
semelhante à vacina BioNTec. Em um estudo inicial, houve 196 casos
confirmados de Covid-19, dos quais 185 estavam no grupo placebo e 11 no
grupo de vacinas.
Ele tem a vantagem sobre este último em
que a formulação de nanopartículas lipídicas diferentes permite que ela seja
armazenada e transportada a 2-8C, em vez do -70C da vacina BioNTec. É
administrado em duas doses, com quatro semanas de diferença.
OUTRAS VACINAS
COVID-19
Na corrida para desenvolver vacinas para o
COVID-19, muitas estratégias mais antigas que mostraram sucesso no passado
também foram utilizadas. Estas incluem vacinas de subunidades, uma abordagem
semelhante à usada para desenvolver as vacinas altamente bem sucedidas para
hepatite B, e partículas de vírus inativadas, uma abordagem usada pela primeira
vez para a vacina de pólio de Salk.
Vacina de
subunidade: NVX-CoV2373, Novavax
A vacina Novavax (NVX-CoV2373) é
baseada em tecnologia mais antiga usando proteína S do SARS-CoV-2
purificada com um adjuvante Matrix M. Em ensaios clínicos, produziu
altos níveis de anticorpos anti-proteína S e foi ordenado por vários
governos como parte de sua estratégia anti-Covid-19. O gene da proteína S é
inserido em um baculovírus. Os Baculoviridae são uma família de vírus
de DNA circular de fita dupla (80-180 pares de bases) que infectam insetos e
artrópodes. O baculovírus modificado é então usado para infectar células de
insetos (geralmente células Sf9, isoladas de Spodoptera frugiperda, a
lagarta do cartucho) que faz a proteína S. Esta forma trímeros nativos na
superfície de células infectadas. Estas proteínas são extraídas e associadas
a nanopartículas lipídicas para que a proteína S seja apresentada ao sistema
imune de forma semelhante às da superfície de uma célula infectada. Um
adjuvante é incluído na vacina extraído de Quillaja saponaria, a
casca de sabão (que, como o nome indica pode ser usado como sabão). No caso
das vacinas, estimula a atração de células imunes ao local da injeção onde
respondem de forma mais eficaz. As propriedades adjuvantes vêm de saponinas
(triterpene glicosides). As nanopartículas contendo a proteína S são tomadas
por células que apresentam antígenos, as proteínas são clivadas a peptídeos
e apresentadas na superfície da célula em associação com o MHC às células T
e B.
Os testes da fase 3 mostraram que esta
vacina tem 89% de eficácia contra o Covid-19 e parece fornecer forte
imunidade contra as variantes do Reino Unido e da África do Sul.
Partículas
de vírus inativadas: Vacina valneva (VLA 2001)
Esta usa uma tecnologia de vacina
ainda mais estabelecida semelhante à usada na vacina contra a poliomielite
de Salk, que é o uso de partículas inteiras inativadas do vírus. O vírus é
cultivado em células de rim Macaco Verde Africano (Vero), purificados e
inativados com um agente como a formalina. A vacina também contém adjuvantes
alum e CpG 1018. CpG 1018 é um agonista de receptor tipo toll 9 (TLR9).
Há uma série de outras vacinas SARS-CoV-2
em ensaios fase I e II que usam partículas de vírus inteiros inativadas por
formalina (Sinovac e Sinopharm)
POR QUE
PRECISAMOS DE DUAS INOCULAÇÕES DE VACINAS?
A maioria das vacinas desenvolvidas contra o
SARS-CoV-2 requer duas vacinas. Isso é por causa da maneira como o sistema
imunológico responde a um patógeno estranho, como um vírus infectante.
Inicialmente, é importante suprimir a
infecção impedindo-o de entrar nas células e se replicar. A infecção por um
vírus ligado ao seu receptor na superfície da célula (ACE2 no caso do
SARS-CoV-2) desencadeia uma resposta inicial na qual linfócitos B (plasmócitos)
produzem anticorpos neutralizantes que se ligam à superfície do organismo
invasor, assim, no caso do SARS-CoV-2, bloqueando a ligação da proteína S do
vírus ao ACE2. A resposta inicial de anticorpos, no entanto, rapidamente diminui,
mas algumas das células B se diferenciam em células B de memória que sobrevivem
por muito tempo e se mudam para a periferia do corpo. Aí eles serão mais
propensos a encontrar mais antígenos durante uma segunda exposição. Quando isso
acontece, eles se proliferam e se diferenciam em mais plasmócitos B, que então
respondem ao antígeno produzindo mais anticorpos. As células B de memória podem
sobreviver por muitos anos para que sejam capazes de responder a múltiplas
exposições ao mesmo antígeno.
Durante a primeira fase da resposta imune, as
células imunes também secretam citocinas que recrutam outras células imunes para
o local da infecção, entre as quais estão células T CD4-positivas e citotóxicas
(células T assassinas) que reconhecem e matam células infectadas pelo vírus.
Como acontece com as células B, algumas células T se diferenciam em células de
memória que podem reativar e proliferar em resposta à nova exposição ao antígeno
original. Essas células T de memória também podem permanecer no corpo por muitos
anos (e talvez por toda a vida).
Uma vez que apenas um pequeno número de
células T de memória são feitas como resultado da exposição inicial, uma segunda
exposição ao antígeno (infecção ou inoculação) é necessária para aumentar seus
níveis. Assim, com as vacinas de RNAm SARS-CoV-2, a proteção começa cerca de 12
dias após a primeira inoculação e sobe para cerca de 50% de eficácia. Após uma
segunda injeção três a quatro semanas depois, começa a segunda fase da resposta
imune, as células B e T aumentam e a eficácia sobe para cerca de 95%.
|
|
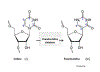 Figura 13 Estrutura da Pseudouridina e Uridina
Figura 13 Estrutura da Pseudouridina e Uridina
 Figura 14 Transcrição de uma molécula de RNAm de vacina de um construto
de DNA plasmidial.
Figura 14 Transcrição de uma molécula de RNAm de vacina de um construto
de DNA plasmidial.
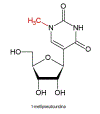 Figura 15
Figura 15
1-metilpseudouridina. Um grupo de metila extra é adicionado
enzimaticamente à base do pseudouracil.
|
 Figura 13 Doenças previníveis por vacinas, por ano de desenvolvimento ou
licença das vacinas - Estados Unidos, 1798-1998 (MMWR/CDC)
Figura 13 Doenças previníveis por vacinas, por ano de desenvolvimento ou
licença das vacinas - Estados Unidos, 1798-1998 (MMWR/CDC) |
Hoje, muitas vacinas antivirais estão
disponíveis e mais estão sendo desenvolvidas. Essas vacinas têm
impactado consideravelmente a saúde pública em todo o mundo (figura 13 e
veja
aqui). |
|
RECURSOS
WEB
Referência de
morbidade anual do século XX e morbidade provisional de 1998 de nove
doenças com vacinas recomendadas antes de 1990 para uso universal em
crianças nos Estados Unidos
MMWR/CDC
As vacinas do seu
filho estão em dia?
CDC |
| |
 Voltar
à Seção Virologia do Microbiologia e Imunologia Online
Voltar
à Seção Virologia do Microbiologia e Imunologia Online
This page last changed on
Friday, March 19, 2021
Page maintained by
Richard Hunt
|

 Figure 1b
Figure 1b Figura 4.
Figura 4. Figura 8
Figura 8 Figura 11 Cepa de vacina atenuada contra influenza usando um mutante
sensível ao frio que pode ser ressortido com novas cepas virulentas
Figura 11 Cepa de vacina atenuada contra influenza usando um mutante
sensível ao frio que pode ser ressortido com novas cepas virulentas

 Figura 12 Anticorpos anti-idiotipo
Figura 12 Anticorpos anti-idiotipo Figura 13 Doenças previníveis por vacinas, por ano de desenvolvimento ou
licença das vacinas - Estados Unidos, 1798-1998 (MMWR/CDC)
Figura 13 Doenças previníveis por vacinas, por ano de desenvolvimento ou
licença das vacinas - Estados Unidos, 1798-1998 (MMWR/CDC)