|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
EM INGLÊS |
PARASITOLOGIA - CAPÍTULO CINCO
CESTODOS (PLATELMINTOS)
Dr
Abdul Ghaffar
Emeritus Professor
University of South Carolina School of Medicine
Dr
Gregory Brower
Associate Professor
University of South Carolina School of Medicine
Tradução:
PhD. Myres Hopkins
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
E-MAIL
DR MYRES HOPKINS |
|
|
|
|

 |
|
|
|
|
|
|
|
OBJETIVOS
Epidemiologia, morbidez e mortalidade
Morfologia do organismo
Ciclo de vida, hospedeiros e vetores
Doença, sintomas e Diagnóstico. Prevenção e controle.
|
Os cestodos clinicamente importantes patogênicos para o homem são
Tenia solium (tênia da carne de porco), T. saginata (tênia da carne de
boi), Diphyllobothrium lattum (tênia dos peixes ou botrocéfalo),
Hymenolepis nana (verme anão), Echinococcus granulosus e E.
multilocularis (doença hidátida).
TENIA SOLIUM T. SAGINATA (TENÍASE)
Epidemiologia
Estes cestodos têm uma distribuição mundial, mas a incidência é maior em
países em desenvolvimento. A taxa de infecção é baixa (de 1 por 1000) na
maior parte da América do Norte e alta (de 10%) no terceiro mundo. Os
platelmintos de porco mostram uma incidência maior, mas esta é
dependente dos hábitos de dieta.
Morfologia
T. saginata podem ter o comprimento de 4 a 6 metros e 12 mm de espessura;
tem uma cabeça piriforme (escolex) com quatro ventosas, mas não há
ganchos ou colo. Tem um corpo longo e achatado com algumas centenas de
segmentos (proglotes). Cada segmento mede cerca de 18 x 6 mm com um
útero ramificado (15-30 ramos). O ovo mede 35 x 45 micrômetros, é
arredondado e amarelo amarronzado. Tem estriações periféricas radiais e
contém um embrião com 3 acúleos (figura 2).
T. solium é ligeiramente menor que a T. saginata. Tem um escólex
globular com quatro ventosas e uma fileira circular de acúleos (rostelo)
que dá uma aparência solar. Há um colo e este tem um longo e achatado
corpo (0.1 m de comprimento). As proglotes medem 5 x 10 mm com um útero
de 7-12 ramos. Os ovos da T. solium e da T. saginata são indistinguíveis
(figura 2).
Ciclo de Vida
Um cisto larval do platelminto (cisticerco) é ingerido em carne mal
cozida; a larva escapa do cisto e passa para o intestino delgado, onde é
ligada à mucosa pelas ventosas do escólex. As proglotes se desenvolvem à
medida que o verme amadurece em 3 a 4 meses. O adulto pode viver no
intestino delgado até 25 anos e elimina proglotes grávidas pelas fezes.
Os ovos expulsos da proglote contaminam e persistem no estado vegetativo
por vários dias, até que são consumidos pelo gado ou porcos, onde irão
eclodir e formar cisticercos (Figura 1).
Sintomas
Infecções leves permanecem assintomáticas, mas infecções intensas podem
produzir desconforto abdominal, dor epigástrica, vômito e diarréia.
Cisticercose
Ovos de T. solium podem também infectar humanos e causar cisticercose (cistos
larvais nos pulmões, fígado, olhos e cérebro) resultando em cegueira e
desordens neurológicas. A incidência da cisticercose cerebral pode ser
de 1 para 1.000 pessoas em uma população e pode ser responsável por 20%
dos casos neurológicos em alguns países (ex. México); o envolvimento da
cisticercose ocular ocorre em cerca de 2.5% dos pacientes e o
envolvimento muscular é de até 10% (na Índia).
Patologia e Imunologia
Sintomas gastrointestinais são devidos à presença o platelminto. Os
sintomas da cisticercose são um resultado de respostas imuno/
inflamatórias. Anticorpos são produzidos na cisticercose e estes são
úteis ferramentas epidemiológicas.
Diagnóstico
O diagnóstico é baseado na recuperação dos ovos ou proglotes nas fezes e
da área perianal. A cisticercose é confirmada pela presença de
anticorpos.
Tratamento e controle
Praziquantel é a droga de escolha. A expulsão do escólex deve ser
averiguada para que o tratamento seja considerado satisfatório. Uma
inspeção da carne bovina e suína, cozimento adequado ou congelamento da
carne são precauções eficientes, visto que os cisticercos não sobrevivem
a temperaturas inferiores a -10o C e acima de 50o C.
|
|
Figura 1
|
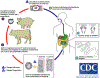
Ciclo de vida da
Taenia saginata e Taenia solium
Os humanos são os únicos hospedeiros definitivos da
Taenia saginata
e Taenia solium. Os ovos ou proglotes grávidas são eliminados
nas fezes  ;
os ovos podem sobreviver durante dias a meses no meio ambiente. Bovinos
(T. saginata) e suínos (T. solium) se tornam infectados
pela ingestão da vegatação contaminada com ovos ou proglotes grávidas ;
os ovos podem sobreviver durante dias a meses no meio ambiente. Bovinos
(T. saginata) e suínos (T. solium) se tornam infectados
pela ingestão da vegatação contaminada com ovos ou proglotes grávidas
 .
No intestino do animal as oncosferas eclodem .
No intestino do animal as oncosferas eclodem
 ,
invadem a parede intestinal, e migram para os músculos estriados, onde
desenvolvem-se em cisticercos. Um cisticerco pode sobreviver durante
vários anos no animal. Os humanos se tornam infectados pela ingestão de
carne crua ou mal cozida infectada ,
invadem a parede intestinal, e migram para os músculos estriados, onde
desenvolvem-se em cisticercos. Um cisticerco pode sobreviver durante
vários anos no animal. Os humanos se tornam infectados pela ingestão de
carne crua ou mal cozida infectada
 .
No intestino humano os cisticercos se desenvolvem durante 2 meses em um
platelminto adulto, que pode sobreviver durante anos. Os platelmintos
adultos se ligam no intestino delgado através de seus escólex .
No intestino humano os cisticercos se desenvolvem durante 2 meses em um
platelminto adulto, que pode sobreviver durante anos. Os platelmintos
adultos se ligam no intestino delgado através de seus escólex
 e
residem no intestino delgado e
residem no intestino delgado
 .
O comprimento dos vermes adultos é normalmente de 5 m ou menos no caso
da T. saginata (entretanto ele pode atingir até 25 m) e de 2 a 7
m no caso da T. solium. Os adultos produzem proglotes que
maturam, tornam-se grávidas, se destacam do platelminto, e migram para o
ânus ou são eliminados pelas fezes (aproximadamente 6 por dia). Adultos
de T. saginata normalmente têm 1.000 a 2.000 proglotes, enquanto
que adultos de T. solium têm uma média de 1.000 proglotes. Os
ovos contidos nas proglotes grávidas são eliminados pelas fezes. T.
saginata podem produzir até 100.000 e T. solium podem
produzir 50.000 ovos por proglote, respectivamente. .
O comprimento dos vermes adultos é normalmente de 5 m ou menos no caso
da T. saginata (entretanto ele pode atingir até 25 m) e de 2 a 7
m no caso da T. solium. Os adultos produzem proglotes que
maturam, tornam-se grávidas, se destacam do platelminto, e migram para o
ânus ou são eliminados pelas fezes (aproximadamente 6 por dia). Adultos
de T. saginata normalmente têm 1.000 a 2.000 proglotes, enquanto
que adultos de T. solium têm uma média de 1.000 proglotes. Os
ovos contidos nas proglotes grávidas são eliminados pelas fezes. T.
saginata podem produzir até 100.000 e T. solium podem
produzir 50.000 ovos por proglote, respectivamente.
CDC
DPDx
Parasite Image Library
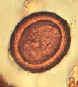
 Figura 2A
Figura 2A
Ovos
tenióides. Os ovos da Taenia saginata e T. solium são
indistinguíveis morfologicamente (a identificação morfológica terá que
se basear nas proglotes ou escólices). Os ovos são arredondados ou
subesféricos, diâmetro de 31 a 43 µm, com uma concha larga radialmente
estriada e marrom. No interior de cada concha está uma oncosfera
embrionada com 6 ganchos. O ovo em B ainda tem a membrana primária que
envolve os ovos nas proglotes.
CDC
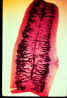
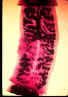 Figura 2B
Figura 2B
Proglotes grávidas de (esquerda)
Taenia saginata e (direita) T. solium. Injeção de tinta da India no útero permite a visualização
dos ramos laterais primários. O número deles permite a diferenciaçãio
entre as duas espécies: T. saginata tem 15 - 20 ramos de cada
lado, enquanto a T. solium tem 7 - 13. Note os poros genitais nas
posições medianas laterais.
CDC
 Figura 2C Figura 2C
Proglote grávida de Taenia saginata
©
Dr
Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão
 Figure 2D Figure 2D
Cisticerco de
Taenia solium , inteiro e em seção do músculo (H&E)
©
Dr
Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão
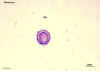 Figura 2E Figura 2E
Ovo de
Taenia sp. egg
©
Dr
Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão
 Figura 2F
Figura 2F
Escolex e proglote grávida de
Taenia solium
©
Dr
Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão
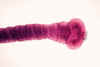 Figura
2G
Figura
2G
Escolex de
Taenia solium.
CDC/Dr. Mae Melvin
 Figura
2G Figura
2G
Histopatologia da
Taenia saginata em apêndice.
CDC
|
| |
|
|
|
|
|
|
DIPHYLLOBOTHRIUM LATUM (TÊNIA DO PEIXE OU BOTROCÉFALO - DIFILOBOTRÍASE)
Epidemiologia
A infecção pela tênia do peixe tem distribuição mundial, nas regiões
sub-árticas e temperadas; é associada com a ingestão de peixes de água
doce mal cozidos.
Morfologia
Esta é a tênia mais longa encontrada em humanos, variando de 3-10 metros
com mais de 3.000 proglotes. O escólex relembra duas folhas de forma
amendoada e as proglotes são mais largas do que longas, morfologia que
se reflete na vida do organismo. Os ovos medem 30 x 50 micrômetros de
tamanho e contém um embrião com 3 pares de acúleos (figura 4).
Ciclo de vida
O Homem e outros animais são infectados por se alimentarem de peixe cru
que contém larvas plerocercóides (15 x 2 mm) que aderem ao intestino
delgado e maturam a vermes adultos em 3 a 5 semanas. Os ovos liberados
das proglotes grávidas no intestino delgado são eliminadas pelas fezes.
O ovo eclode na água doce para produzir um coracídio que precisa ser
ingerido por uma pulga d'água (Cíclope) onde se desenvolve em uma larva
procercóide. As Cíclopes quando infectadas são ingeridas pelo peixe de
água doce, a larva procercóide penetra na parede intestinal e se
desenvolve em uma larva plerocercóide, que é infecciosa para o homem (figura
3).
Sintomas
Os sintomas clínicos podem ser amenos, dependendo do número de vermes.
Eles incluem desconforto abdominal, perda de peso, perda de apetite e
algum grau de desnutrição. Anemia e problemas neurológicos associados
com a deficiência de vitamina B12 são observados em indivíduos
intensamente infectados.
Diagnóstico
O diagnóstico é baseado no achado de muitos ovos típicos e proglotes
vazias nas fezes (Figura 3). A história de consumo de peixe cru e
residência em uma localidade endêmica é útil.
Tratamento e controle
Praziquantel é a droga de escolha. O congelamento por 24 horas, o
cozimento completo ou fazer picles com o peixe mata as larvas. Os
reservatórios de peixes devem ser mantidos longe de água de esgôto.
|
|
|
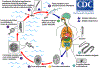 Figura 3
Figura 3
Ovos imatudos são eliminados nas fezes
 .
Sob condições apropriadas, os ovos maturam (aproximadamente 18 a 20
dias) .
Sob condições apropriadas, os ovos maturam (aproximadamente 18 a 20
dias)
 e
produzem oncosferas, que se desenvolvem em um coracídio e
produzem oncosferas, que se desenvolvem em um coracídio
 .
Após a ingestão por um crustáceo de água doce adequado (a copépoda,
primeiro hospedeiro intermediário) o coracídio se desenvolve em larva
procercóide .
Após a ingestão por um crustáceo de água doce adequado (a copépoda,
primeiro hospedeiro intermediário) o coracídio se desenvolve em larva
procercóide
 .
Após a ingestão do copépoda por um segundo hospedeiro intermediário
adequado, tipicamente o peixe fluvial vairão e outros pequenos peixes de
água doce, as larvas procercóides são liberadas do crustáceo e migram
para a carne do peixe onde se desenvolvem em larvas plerocercóides
(espárgano) .
Após a ingestão do copépoda por um segundo hospedeiro intermediário
adequado, tipicamente o peixe fluvial vairão e outros pequenos peixes de
água doce, as larvas procercóides são liberadas do crustáceo e migram
para a carne do peixe onde se desenvolvem em larvas plerocercóides
(espárgano)
 .
As larvas plerocercóides são o estágio infeccioso para humanos. Devido
ao fato de humanos em geral não se alimentarem de vairões mal cozidos e
de peixes semelhantes de água doce, estes não representam uma fonte
importante de infecção. Entretanto, estes pequenos segundos hospedeiros
intermediários podem ser comidos por espécies predadoras maiores, ex. a
truta, perca, dourada amarela .
As larvas plerocercóides são o estágio infeccioso para humanos. Devido
ao fato de humanos em geral não se alimentarem de vairões mal cozidos e
de peixes semelhantes de água doce, estes não representam uma fonte
importante de infecção. Entretanto, estes pequenos segundos hospedeiros
intermediários podem ser comidos por espécies predadoras maiores, ex. a
truta, perca, dourada amarela
 .
Neste caso, o espárgano pode migrar para a musculatura do peixe predador
maior e humanos podem adquirir a doença ao comer estes peixes
hospedeiros secundários intermediários infectados crus ou mal cozidos .
Neste caso, o espárgano pode migrar para a musculatura do peixe predador
maior e humanos podem adquirir a doença ao comer estes peixes
hospedeiros secundários intermediários infectados crus ou mal cozidos
 .
Após a ingestão do peixe infectado, a plerocercóide se desenvolve em
adultos imaturos e daí em platelmintos adultos maduros que irão residir
no intestino delgado. Os adultos de D. latum se ligam à mucosa
intestinal por meio de duas fendas bilaterais (bótria) de seus escólex .
Após a ingestão do peixe infectado, a plerocercóide se desenvolve em
adultos imaturos e daí em platelmintos adultos maduros que irão residir
no intestino delgado. Os adultos de D. latum se ligam à mucosa
intestinal por meio de duas fendas bilaterais (bótria) de seus escólex
 .
Os adultos podem atingir mais de 10 m de comprimento, com mais de 3.000
proglotes. Ovos imaturos são liberados das proglotes (até1.000,000 de
ovos por dia por verme) .
Os adultos podem atingir mais de 10 m de comprimento, com mais de 3.000
proglotes. Ovos imaturos são liberados das proglotes (até1.000,000 de
ovos por dia por verme)
 e
são eliminados nas fezes e
são eliminados nas fezes
 .
Os ovos aparecem nas fezes 5 a 6 semanas após a infecção. Além disso
humanos, muitos outros mamíferos podem também servir de hospedeiros
definitivos para o D. latum. .
Os ovos aparecem nas fezes 5 a 6 semanas após a infecção. Além disso
humanos, muitos outros mamíferos podem também servir de hospedeiros
definitivos para o D. latum.
CDC
DPDx
Parasite Image Library
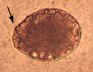
 Figura
4A Figura
4A
Ovos de Diphyllobothrium latum. Estes ovos são ovais ou elipsóides, com
um opérculo (ver setas) em um terminal que podem ser inconspícuos (à
direita). No extremo oposto (abopercular) há um pequeno nó que pode ser
dificilmente discernível (à esquerda). Os ovos são eliminados nas fezes
não embrionados. O tamanho varia: 58 a 76 µm por 40 a 51 µm.
CDC. Image
A contribuição da Divisão de Saúde Pública da Georgia.
 Figura 4B
Figura 4B
Proglotes grávidas de Diphyllobothrium latum.
CDC/Dr. Mae Melvin
 Figura
4C Figura
4C
Proglotes de Diphyllobothrium latum. As espécias características são: as
proglotes são mais largas do que longas; tamanho de 2 a 4 mm de
comprimento por 10 a 12 mm de largura; útero torcido em aparência de
roseta; poro genital no centro da proglote.
CDC
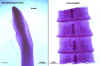 Figura
4E Figura
4E
Escólex e proglotes grávidas de Diphyllobothrium latum
© Dr Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão
 Figura
4D Figura
4D
Proglotes de Diphyllobothrium latum. Estas proglotes tendem a ser
eliminadas em seções de vários comprimentos nas fezes. As proglotes
tendem a ser mais largas do que longas.
CDC. contribuição da Divisão de
Saúde Pública da Georgia.
 Figura
4F Figura
4F
Ovo de Diphyllobothrium latum
© Dr Peter Darben, Coleção de
parasitologia clínica da Universidade de Tecnologia de Queensland. Usado
com permissão
|
|
Figure
4
|
|
|
HYMENOLEPIS NANA (VERME ANÃO)
Este é um platelminto anão (20 x 0.7 mm) que infecta crianças. Roedores são os
reservatórios. A infecção é oral-fecal e, portanto, a infecção cruzada e auto-infecção
pelos ovos nas fezes é normal (figura 6). O verme se desenvolve a partir dos
ovos ingeridos em um adulto no intestino delgado e aí reside durante várias
semanas (figura 5). Infecções leves produzem distúrbios abdominais vagos, mas
infecções mais intensas podem causar enterite. O diagnóstico é baseado no achado
de ovos nas fezes. Praziquantel é a droga de escolha. A higiene é o melhor
controle.
|
|
|
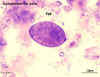
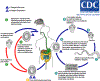 Figura 5
Figura 5
Ovos de Hymenolepis nana são imediatamente infecciosos quando
eliminados nas fezes e não sobrevivem mais de 10 dias no ambiente
externo
 .
Quando os ovos são ingeridos por um hospedeiro intermediário artrópodo .
Quando os ovos são ingeridos por um hospedeiro intermediário artrópodo
 (várias
espécies de escaravelhos e pulgas podem servir como hospedeiros
intermediários), eles se desenvolvem em cisticercóides, que podem
infectar humanos ou roedores pela ingestão (várias
espécies de escaravelhos e pulgas podem servir como hospedeiros
intermediários), eles se desenvolvem em cisticercóides, que podem
infectar humanos ou roedores pela ingestão
 e
se desenvolvem em adultos no intestino delgado. Um variante
morfologicamente idêntico, H. nana var. fraterna, infecta
roedores e usa artrópodos como hospedeiros intermediários. Quando ovos
são ingeridos e
se desenvolvem em adultos no intestino delgado. Um variante
morfologicamente idêntico, H. nana var. fraterna, infecta
roedores e usa artrópodos como hospedeiros intermediários. Quando ovos
são ingeridos
 (em
alimentos contaminados ou água, ou pelas mãos contaminadas com fezes),
as oncosferas contidas nos ovos são liberadas. As oncosferas (larvas
hexacanto) penetram no vilo intestinal e se desenvolvem em lasvas
cisticercóides (em
alimentos contaminados ou água, ou pelas mãos contaminadas com fezes),
as oncosferas contidas nos ovos são liberadas. As oncosferas (larvas
hexacanto) penetram no vilo intestinal e se desenvolvem em lasvas
cisticercóides
 .
Com o rompimento dos vilus, as cisticercóides retornam ao lúmen
intestinal, evaginam seus escólices .
Com o rompimento dos vilus, as cisticercóides retornam ao lúmen
intestinal, evaginam seus escólices
 ,
atacam a mucosa intestinal e se desenvolvem em adultos, que residem na
porção ilíaca do intestino delgado profduzindo proglotes grávidas ,
atacam a mucosa intestinal e se desenvolvem em adultos, que residem na
porção ilíaca do intestino delgado profduzindo proglotes grávidas
 .
Os ovos são eliminados nas fezes quando liberados das proglotes através
de seus átrios genitais ou quando as proglotes desintegram no intestino
delgado .
Os ovos são eliminados nas fezes quando liberados das proglotes através
de seus átrios genitais ou quando as proglotes desintegram no intestino
delgado
 .
Um modo alternativo de infecção consiste em uma autoinfecção, quando os
ovos liberam seus embriões hexacantos, que penetram o vilus continuando
o ciclo infeccioso sem a passagem pelo meio externo .
Um modo alternativo de infecção consiste em uma autoinfecção, quando os
ovos liberam seus embriões hexacantos, que penetram o vilus continuando
o ciclo infeccioso sem a passagem pelo meio externo
 .
A duração da vida dos vermes adultos é de 4 a 6 semanas, mas a
auto-infecção interna permite que a infecção persista durante anos. .
A duração da vida dos vermes adultos é de 4 a 6 semanas, mas a
auto-infecção interna permite que a infecção persista durante anos.
CDC
DPDx Parasite Image Library
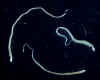 Figura 6A
Figura 6A
Três adultos de platelmintos Hymenolepis nana. Cada verme (comprimento:
15-40 mm) tem um pequeno escólex arrredondado na extremidade anterior, e
proglotes podem ser distinguidas na extremidade mais larga posterior.
CDC. Imagem é contribuição da Divisão de Saúde Pública da Georgia.
 Figura 6B
Figura 6B
Ovo de Hymenolepis diminuta. Esses ovos são arredondados ou ligeiramente
ovais, tamanho 70 - 86 µm X 60 - 80 µm, com uma membrana externa
estriada e uma membrana interna fina. O espaço entre estas membranas é
liso ou suavemente granular. A oncosfera tem seis ganchos (dos quais
pelo menos quatro são visíveis neste nível de foco).
CDC. Imagem é
contribuição da Divisão de Saúde Pública da Georgia.
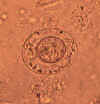 Figura 6C
Figura 6C
Ovos de Hymenolepis nana. Esses ovos são ovais ou sub-esféricos e
menores do que os da H. diminuta, sendo seu tamanho 40 - 60 µm X 30 - 50
µm. Na membrana interna existem dois polos, dos quais se espalham 4-8
filamentos polares para fora entre as duas membranas. As oncosferas têm
seis ganchos (vistos como linhas escuras no local 8 horas).
CDC. Imagem
é contribuição da Divisão de Saúde Pública da Georgia.
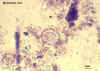 Figura 6D
Figura 6D
Ovo de Hymenolepis nana
© Dr Peter Darben, Coleção de parasitologia
clínica da Universidade de Tecnologia de Queensland. Usado com permissão
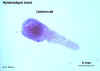 Figure 6E
Figure 6E
Cisticercóide de Hymenolepis nana
© Dr Peter Darben, Coleção de
parasitologia clínica da Universidade de Tecnologia de Queensland. Usado
com permissão
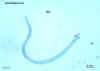 Figure 6F
Figure 6F
Adulto de Hymenolepis nana
© Dr Peter Darben, Coleção de parasitologia
clínica da Universidade de Tecnologia de Queensland. Usado com permissão
|
|
|
| |
|
|
EQUINOCOCOSE (HIDATIDOSE)
Echinococcus granulosus e E. multilocularis agentes causadores dos
cistos hidáticos.
|
| |
ECHINOCOCCUS GRANULOSUS
Epidemiologia
O organismo é comum na Asia, Australia, Africa Oriental, Espanha
Meridional, partes meridionais da América do Sul e Norte da America do
Norte. A incidência de infecções humanas é de cerca de 1 a 2 por 1.000
pessoas e pode ser maior em áreas rurais de regiões afetadas.
Morfologia
Este é o menor de todos os platelmintos (3 a 9 mm de comprimento) com 3
proglotes.
Ciclo de vida
Os vermes adultos vivem em animais domésticos e carnívoros selvagens. Os
ovos eliminados pelos animais infectados, são ingeridos pelos animais da
fazenda que estão pastando ou pelo homem, se localizam em diferentes
órgãos e se desenvolvem em cistos hidáticos que contém muitas larvas
(proto-escólices ou areia hidática) (Figura 8). Quando outros animais
consomem órgãos infectados desses animais, as proto-escólices escapam do
cisto, entram no intestino delgado e se desenvolvem em vermes adultos (Figura
7). Ovos de Echinococcus quando deglutidos pelo homen, produzem embriões
que penetram no intestino delgado, entram na circulação e formam cistos
no fígado, pulmões, ossos, e às vezes, no cérebro. O cisto é redondo e
mede 1 a 7 cm de diâmetro, embora ele possa crescer e ter 30 cm. O cisto
consiste de uma cutícula hialina anuclear e uma camada incubadora
nucleada interna que contém um fluido claro amarelo. Cistos-filhos
aderem à camada incubadora, embora alguns cistos, conhecidos como cistos
reprodutivos, podem ter apenas larvas (areia hidática). O homem é um
hospedeiro terminal.
Sintomas
Os sintomas, comparáveis àqueles de um tumor de crescimento lento,
dependem da localização do cisto. Grandes cistos abdominais produzem
descorforto crescente. Cistos hepáticos provocam icterícia obstrutiva.
Cistos peribronquiais produzem abcessos pulmonares. Cistos cerebrais
produzem aumento de pressão intracraniana e epilepsia Jacksoniana.
Cistos renais provocam disfunção renal. Os conteúdos de um cisto podem
provocar respostas anafiláticas.
Diagnóstico
Os sintomas clínicos de um tumor de crescimento lento acompanhados de
eosinofilia são sugestivos. O teste intradérmico (Casoni) com fluido
hidático é útil. Cistos pulmonares e cistos calcificados podem ser
visualizados pelo uso de raios X. Anticorpos contra antígenos do fluido
hidático têm sido detectacos em uma grande propulação de indivíduos
infectados por ELISA ou pelo teste indireto de hemaglutinação.
Tratamento e controle
O tratamento envolve remoção cirúrgica do cisto ou inativação da areia
hidática pela injeção do cisto com formalina 10% e sua remoção dentro de
poucos minutos (4-5 min). Praziquantel tem sido demonstrado eficiente em
muitos casos. Albendazol, em altas doses, é uma alternativa. Medidas
preventivas envolvem evitar contato com cães infectados e gatos e a
eliminação da infecção neles.
|
|
|
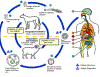 Figura 7
Figura 7
O adulto de
Echinococcus granulosus (3 a 6 mm de comprimento) (1)
reside no intestino delgado dos hospedeiros definitivos, cães o outros
canídeos. Proglotes grávidas liberam ovos (2) que são eliminados nas
fezes. Após a ingestão por um hospedeiro intermediário adequado (em
condições naturais:carneiros, cabras, suinos, gado, cavalos, camelos), o
ovo eclode no intestino delgado e libera uma oncosfera (3) que penetra
na parede intestinal e migra através do sistema circulatório para vários
órgãos, especialmente o fígado e pulmões. Nesses órgãos a oncosfera se
desenvolve em um cisto (4) que aumenta gradualmente, produzindo
proto-escólices e cistos-filhos que preenchem o interior do cisto. O
hospedeiro definitivo torna-se infectado pela ingestão de órgãos
contendo cistos dos hospedeiros intermediários infectados. Após a
ingestão, os proto-escólices (5) evaginam, aderem à mucosa intestinal
(6), e se desenvolvem em estágios adultos (1) em 32 a 80 dias. O mesmo
ciclo de vida ocorre com E. multilocularis (1,2 a 3,7 mm), com as
seguintes diferenças: os hospedeiros definitivos são raposas, e em menor
extensão cães, gados, coiotes e lobos; os hospedeiros intermediários são
pequenos roedores; e o crescimento larval (no fígado) permanece
indefinidamente no estágio proliferativo, resultando na invasão dos
tecidos adjacentes. Com o E. vogeli (até 5,6 mm de comprimento),
os hospedeiros definitivos são cachorro do mato e cães; os hospedeiros
intermediários são roedores; e o estágio larval (no fígado, pulmões e
outros órgãos) se desenvolvem externamente e internamente, resultando em
múltiplas vesículas. O E. oligarthrus (até 2,9 mm de comprimento)
tem um ciclo de vida que envolve felinos selvagens como hospedeiros
definitivos e roedores como hospedeiros intermediários. Seres humanos
tornam-se infectados pela ingestão de ovos (2), com liberação resultante
de oncosferas (3) no intestino e desenvolvimento de cistos (4) em vários
órgãos
CDC
DPDx
Parasite Image Library
 Figura
8A Figura
8A
"Areia hidática". Fluido aspirado de um cisto hidático mostra múltiplos
proto-escólices (medindo aproximadamente 100 µm), cada um dos quais
apresentando seus acúleos típicos. As proto-escólices são normalmente
invaginadas (à esquerda), e evaginadas (no meio, depois à direita)
quando colocadas em solução salina.
CDC Imagem é contribuição da Divisão
de Saúde Pública da Georgia.
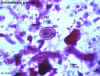 Figura
8B Figura
8B
Ovo de Echinococcus granulosus
© Dr Peter Darben, Coleção de
parasitologia clínica da Universidade de Tecnologia de Queensland. Usado
com permissão
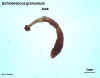 Figura
8C Figura
8C
Adulto de Echinococcus granulosus
© Dr Peter Darben, Coleção de
parasitologia clínica da Universidade de Tecnologia de Queensland. Usado
com permissão
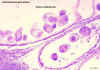 Figura
8D Figura
8D
Cisto hidático de Echinococcus granulosus em seção de pulmão (H&E)
© Dr
Peter Darben, Coleção de parasitologia clínica da Universidade de
Tecnologia de Queensland. Usado com permissão
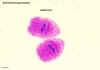 Figura
8E Figura
8E
Areia hidática de Echinococcus granulosus
© Dr Peter Darben, Coleção de
parasitologia clínica da Universidade de Tecnologia de Queensland. Usado
com permissão
 Figura
8F Figura
8F
Histopatologia de cisto hidático. Echinococcus, equinococose
CDC/Dr.
Mae Melvin
 Figura
8G Figura
8G
Cistos hidáticos
 Figura 8F
Figura 8F
Patologia grosseira de rato-do-algodoeiro infectado com Echinococcus
multilocularis. Primeiro E. locularis isolado nos próprios Estados
Unidos.
CDC/Dr. I. Kagan
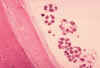 Figura
8G Figura
8G
Histopatologia de Echinococcus granulosus em um carneiro. Espêsso e
fibroso pericisto, ectocisto hialino e cápsulas de incubação cheias de
proto-escólices são visíveis.
CDC/Dr.Peter Schantz
 Figura 8H
Figura 8H
Patologia grosseira da membrana e cistos hitáticos-filhos de pulmão
humano
CDC/Dr. I. Kagan
 Figura 8I
Figura 8I
Braço de homem mostrando teste cutâneo positivo para a doença hidática (equinococose)
CDC/Dr. I. Kagan
|
|
Figura
8
|
| |
| |
| |
Echinococcus multilocularis
Este é um platelminto similar ao E. granulosus, que também causa
hidatose nas porções setentrionais da Ásia e da América do Norte. Tem
uma morfologia semelhante e ciclo de vida, exceto pelo fato de que
roedores são os seus hospedeiros intermediários. Humanos, quando
infectados por este verme, também desenvolvem cistos hidáticos, que
produzem sintomas semelhantes aos dos causados pelo E. granulosus.
Entretanto, os cistos são multiloculares (muitas câmaras). O organismo é
resistente a Praziquantel; altas doses de Albendazol apresenta algum
efeito anti-parasitário. A cirurgia é a forma de remover o cisto. O
controle de roedores é a forma de prevenção.
|
Sumário |
|
Organismo |
Transmissão |
Sintomas |
Diagnóstico |
Tratamento |
| Tenia saginata
|
Cisto na carne |
Dor epigástrica, vômito, diarréia |
Proglotes de ovos nas fezes ou na área perianal
|
Praziquantel |
|
Tenia solium
|
Cisto no porco |
Dor epigástrica, vômito, diarréia |
Proglotes ou ovos nas fezes ou na área perianal
|
Praziquantel |
| T. solium Cysticercosis |
Oro-fecal |
Dor muscular e fraqueza, problemas neurológicos e oculares |
Roentgenografia, anticorpos anti-cisticerco (EIA)
|
Praziquantel |
|
D. latum
|
Cisto no peixe |
Dor abdominal, perda de peso, anorexia, desnutrição e problemas de
deficiência de vitamina B12 |
Proglotes ou ovos nas fezes ou na área perianal |
Praziquantel |
|
E. granulosus
|
Oro-fecal |
Grandes cistos produzem vários sintomas dependendo da localização no
organismo. |
Roentgenografia, anticorpos anti-fluido hidático (EIA), Teste cutâneo de
Casoni |
Cirurgia, injeção de formalina e drenagem, Praziquantel |
|
E. multiloculoris |
Oro-fecal |
Idem |
Idem |
Cirurgia, Albendazol |
|
|
|
 Voltar à Seção de Parasitologia do Microbiologia e Imunologia Online
Voltar à Seção de Parasitologia do Microbiologia e Imunologia Online
This page last changed on
Monday, January 23, 2017
Page maintained by
Richard Hunt
|






































