|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
PARASITOLOGIA – CAPÍTULO QUATRO
NEMATODOS (Lombrigas)
Dr
Abdul Ghaffar
Emeritus Professor
University of South Carolina School of Medicine
Tradução:
PhD. Myres Hopkins
|
|
|
|
EM INGLÊS
|
|
SHQIP - ALBANIAN |
Dê a
sua opinião
CONTATO |
|
BUSCA |
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|
|

 |
Aprenda Plugado |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
Todos os diagramas com ciclo de vida nesta seção são cortesia de
DPDx Parasite Image Library
Centros para Contrôle de Doenças (CDC)
OBJETIVOS
Epidemiologia, morbidez e mortalidade do organismo,
Ciclo de vida, hospedeiros e vetores
Doença, sintomas, patogênese e Diagnóstico
Prevenção e controle |
HELMINTOS INTESTINAIS
Os nematódios intestinais de importância para o homem são:
-
Ascaris lumbricoides (lombrigas)
-
Trichinella spiralis (triquinose)
-
Trichuris trichiura (tricocéfalos)
-
Enterobius vermicularis (oxiúros)
-
Strongyloides stercoralis (diarréia da Cochinchina)
-
Ancylostoma duodenale and Necator americanus (verme do amarelão)
-
Dracunculus medinensis (serpente de fogo dos Israelitas).
E. vermicularis e T. trichiura são parasitas exclusivamente intestinais. Outros
helmintos listados acima têm fase intestinal e nos tecidos.
|
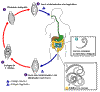
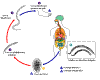
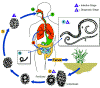 Figura 1
Figura 1
Ciclo de vida do Áscaris
Vermes adultos
 vivem no lúmen do intestino delgado. Uma fêmea produz aproximadamente
200.000 ovos por dia, que são eliminados pelas fezes
vivem no lúmen do intestino delgado. Uma fêmea produz aproximadamente
200.000 ovos por dia, que são eliminados pelas fezes
 .
Ovos não fertilizados não ingeridos mas não são infectivos. Ovos
férteis se embrionam e se tornam infectivos após 18 dias a algumas
semanas .
Ovos não fertilizados não ingeridos mas não são infectivos. Ovos
férteis se embrionam e se tornam infectivos após 18 dias a algumas
semanas
 ,
dependendo das condições ambientais (optimas: humidade, calor, solo
sombrio). Após infectivos os ovos são deglutidos ,
dependendo das condições ambientais (optimas: humidade, calor, solo
sombrio). Após infectivos os ovos são deglutidos
 ,
as larvas eclodem ,
as larvas eclodem
 ,
invadem a mucosa intestinal, e são levados via circulação portal, e
depois pela circulação sistêmica para os pulmões ,
invadem a mucosa intestinal, e são levados via circulação portal, e
depois pela circulação sistêmica para os pulmões
 .
As
larvas maturam posteriormente nos pulmões (10 a 14 dias), penetram nas
paredes alveolares, ascendem pela árvore bronquial para a garganta, e
são deglutidos .
As
larvas maturam posteriormente nos pulmões (10 a 14 dias), penetram nas
paredes alveolares, ascendem pela árvore bronquial para a garganta, e
são deglutidos
 .
Ao
atingirem o intestino delgado, elas se desenvolvem em vermes adultos .
Ao
atingirem o intestino delgado, elas se desenvolvem em vermes adultos
 .
Cerca
de 2 a 3 meses se passam entre a ingestão dos ovos infectivos e a
ovoposição pela fêmea adulta. Vermes adultos podem viver de 1 a 2 anos. .
Cerca
de 2 a 3 meses se passam entre a ingestão dos ovos infectivos e a
ovoposição pela fêmea adulta. Vermes adultos podem viver de 1 a 2 anos.
CDC
|
|
|
Ascaris
lumbricoides
(Grandes lombrigas intestinais)
Epidemiologia
A morbidez
annual global devida a infecções por áscaris é estimada em 1 bilhão, com uma
mortalidade de 20.000. Ascaridíase pode ocorrer em todas as idades, mas é mais
comum no grupo de idade de 5 a 9 anos. A incidência é maior em populações rurais
pobres.
Morfologia
O verme-fêmea
mede em média 30 cm x 5 mm. O macho é menor.
Ciclo de vida
(figura 1)
A infecção ocorre pela ingestão de alimentos contaminados com ovos infectivos
que eclodem na parte superior do intestino delgado. A larva (250 x 15
micrometros) penetram na parede intestinal e entram nas vênulas ou vasos
linfáticos. As larvas passam pelo fígado, coração e pulmão até chegarem aos
alvéolos em 1 a 7 dias, em cujo período elas crescem até 1.5 cm. Elas migram até
os brônquios, ascendem a traquéia até a glote, e descem pelo esôfago para o
intestino delgado onde elas maturam em 2 ou 3 meses. Uma fêmea pode viver no
intestino por 12 a 18 meses e tem a capacidade de produzir 25 milhões de ovos
com uma média diária de 200.000 ovos (figura 2). Os ovos são excretados nas
fezes, e sob condições favoráveis (21 a 30 graus C, humidade, ambiente
ventilado) larvas infectivas são formadas dentro do ovo. Os ovos são resistentes
a desinfetantes químicos e sobrevivem por meses em esgôtos, mas são mortos pelo
aquecimento (40 graus C por 15 horas). A infecção é de homem para homem. Pode
ocorrer autoinfecção.
Sintomas
Os sintomas
estão relacionados à presença do verme. Dez a vinte vermes pode passar
desapercebidos, exceto em um exame rotineiro de fezes. A queixa mais comum é
leve dor abdominal. Em casos mais severos, o paciente pode apresentar apatia,
perda de pêso, anorexia, abdomen distendido, fezes amolecidas intermitentes e
vômitos ocasionais. Durante o estágio pulmonar, pode haver um breve período de
tosse, dificuldades respiratórias,
dispnéia
e desconforto sub-external. A maior parte dos sintomas se deve à presença física
do verme.
Diagnose
O diagnóstico é
baseado na identificação dos ovos (40 a 70 micrômetros por 35 a 50 micrômetros -
figura 2) nas fezes.
Tratamento e
Prevenção
Mebendazol, 200 mg,
para adultos e 100 mg para crianças, durante 3 dias é suficiente. Boa higiene é
a melhor medida preventiva.
|
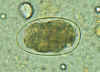
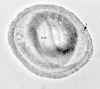
| Figura 2
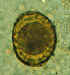 Um ôvo de áscaris fertilizado, ainda no estágio unicelular, forma
eliminada nas fezes. Os ovos estão normalmente neste estágio quando
eliminados pelas fezes (O desenvolvimento completo da larva requer 18
dias em condições favoráveis).
CDC
DPDx
Parasite Image Library
Um ôvo de áscaris fertilizado, ainda no estágio unicelular, forma
eliminada nas fezes. Os ovos estão normalmente neste estágio quando
eliminados pelas fezes (O desenvolvimento completo da larva requer 18
dias em condições favoráveis).
CDC
DPDx
Parasite Image Library |
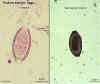
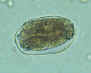
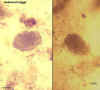
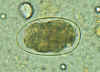
 Ovos, não fertilizado (à esquerda) e fertilizado (à direita).
Paciente do Haiti. CDC
DPDx
Parasite Image Library
Ovos, não fertilizado (à esquerda) e fertilizado (à direita).
Paciente do Haiti. CDC
DPDx
Parasite Image Library |
 Ovo não fertilizado. Mamilações proeminentes da camada externa. Menino
de 10 anos examinado em Cherokee, Carolina do Norte. CDC
DPDx Parasite Image Library
Ovo não fertilizado. Mamilações proeminentes da camada externa. Menino
de 10 anos examinado em Cherokee, Carolina do Norte. CDC
DPDx Parasite Image Library
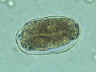
 Ovo fertilizado. O embrião pode ser distinguido dentro do ovo. The
embryo can be distinguished inside the egg. Menino de 10 anos examinado
em Cherokee, Carolina do Norte. CDC
DPDx
Parasite Image Library
Ovo fertilizado. O embrião pode ser distinguido dentro do ovo. The
embryo can be distinguished inside the egg. Menino de 10 anos examinado
em Cherokee, Carolina do Norte. CDC
DPDx
Parasite Image Library
 Ovo não fertilizado sem camada externa mamilada (descorticada). Paciente
visto durante uma coleta na Bolivia. CDC
DPDx Parasite Image Library
Ovo não fertilizado sem camada externa mamilada (descorticada). Paciente
visto durante uma coleta na Bolivia. CDC
DPDx Parasite Image Library
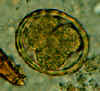
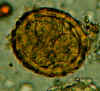 Dois ovos fertilizados do mesmo paciente, onde embriões começaram a se
desenvolver (isso acontece quando a amostra de fezes não é processada
por alguns dias e sem refrigeração). Os embriões no estágio inicial da
divisão (4-6 células) podem ser claramente vistos. Note que o ovo à
esquerda tem uma camada externa mamilada muito fina.. CDC
DPDx
Parasite Image Library
Dois ovos fertilizados do mesmo paciente, onde embriões começaram a se
desenvolver (isso acontece quando a amostra de fezes não é processada
por alguns dias e sem refrigeração). Os embriões no estágio inicial da
divisão (4-6 células) podem ser claramente vistos. Note que o ovo à
esquerda tem uma camada externa mamilada muito fina.. CDC
DPDx
Parasite Image Library
 Larva eclodindo de um ovo. CDC
DPDx
Parasite Image Library
Larva eclodindo de um ovo. CDC
DPDx
Parasite Image Library
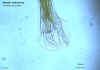
 Um verme de Áscaris adulto. Características diagnósticas: extreminades
afuniladas; comprimento 15-35 cm (as fêmeas tendem a ser as maiores).
Este verme é uma fêmea, conforme evidenciado pelo tamanho e pela cinta
genital (depressão circular escura a área inferior da imagem). Verme
eliminado por uma menina na Flórida. CDC
DPDx Parasite Image Library
Um verme de Áscaris adulto. Características diagnósticas: extreminades
afuniladas; comprimento 15-35 cm (as fêmeas tendem a ser as maiores).
Este verme é uma fêmea, conforme evidenciado pelo tamanho e pela cinta
genital (depressão circular escura a área inferior da imagem). Verme
eliminado por uma menina na Flórida. CDC
DPDx Parasite Image Library

Áscaris lumbricoides adultos macho e fêmeae ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
 Ascaris lumbricoides larva em corte de pulmão (H&E) ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Ascaris lumbricoides larva em corte de pulmão (H&E) ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
|
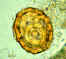 Ovo contendo uma larva, que será infectiva se ingerida. Paciente de
Léogane, Haiti. CDC
DPDx Parasite Image Library
Ovo contendo uma larva, que será infectiva se ingerida. Paciente de
Léogane, Haiti. CDC
DPDx Parasite Image Library |
|
Figura 3
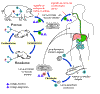 Triquinelose é adquirida pela ingestão de carne contendo cistos (larva
encistada)
Triquinelose é adquirida pela ingestão de carne contendo cistos (larva
encistada)
 de Trichinella. Após a exposição ao ácido gástrico e pepsina, as
larvas são liberadas
de Trichinella. Após a exposição ao ácido gástrico e pepsina, as
larvas são liberadas
 dos cistos e invadem a mucosa do intestino delgado onde se desenvolvem
em vermes adultos
dos cistos e invadem a mucosa do intestino delgado onde se desenvolvem
em vermes adultos
 (fêmea 2.2 mm de comprimento, machos 1.2 mm; período de vida no
intestino delgado: 4 semanas). Após 1 semana, as fêmeas liberam larvas
(fêmea 2.2 mm de comprimento, machos 1.2 mm; período de vida no
intestino delgado: 4 semanas). Após 1 semana, as fêmeas liberam larvas
 que migram para os músculos estriados onde se encistamt
que migram para os músculos estriados onde se encistamt
 .
Trichinella pseudospiralis,
entretanto, não encista. O encistamento se completa em 4 a 5 semanas e a
larva encistada permanece viável por alguns anos. A ingestão das larvas
encistadas perpetua o ciclo. Ratos e roedores são os principais
responsáveis pela manutenção da endemicidade desta infecção. Animais
carnívoros/onívoros, como porcos ou ursos, se alimentam de roedores
mortos ou de carne de outros animais infectados. Diferentes hospedeiros
animais estão implicados no ciclo de vida de diferentes espécies de
Trichinella. Humanos são acidentalmente infectados ao comerem carne
impropriamente processada desses animais carnívoros (ou comerem
alimentos contaminados como carne).
CDC
DPDx Parasite Image Library .
Trichinella pseudospiralis,
entretanto, não encista. O encistamento se completa em 4 a 5 semanas e a
larva encistada permanece viável por alguns anos. A ingestão das larvas
encistadas perpetua o ciclo. Ratos e roedores são os principais
responsáveis pela manutenção da endemicidade desta infecção. Animais
carnívoros/onívoros, como porcos ou ursos, se alimentam de roedores
mortos ou de carne de outros animais infectados. Diferentes hospedeiros
animais estão implicados no ciclo de vida de diferentes espécies de
Trichinella. Humanos são acidentalmente infectados ao comerem carne
impropriamente processada desses animais carnívoros (ou comerem
alimentos contaminados como carne).
CDC
DPDx Parasite Image Library |
Trichinella spiralis
(Triquinose)
Epidemiologia
Triquinose
está relacionada com a qualidade do porco e consumo de carne mal cozida.
Amostras de autópsia indicam que cerca de 2 por cento da população está
infectada. O índice de mortalidade é baixo.
Morfologia
A fêmea
adulta mede 3.5 mm x 60 micrômetros. As larvas no tecido (100
micrômetros x 5 micrômetros) estão enroladas em uma cápsula com a forma
de bola de futebol americano.
Ciclo de vida
A infecção
ocorre pela ingestão das larvas, em carne mal cozida, que imetiatamente
invadem a mucosa intestinal e se diferenciam sexualmente em 18 a 24
horas. A fêmea, após a fertilização, enterra-se profundamente na mucosa
intestinal, enquanto que o macho é expelido (estágio intestinal). Por
volta do 5º dia os ovos começam a eclodir no verme feminino e larvas
jovens são depositadas na mucosa, de onde elas atingem os vasos
linfáticos, linfonodos e a corrente sanguínea (migração larval). A
dispersão larval ocorre 4 a 16 semanas após a infecção. As larvas são
depositadas na fibra muscular e no músculo estriado, elas formam uma
cápsula que se calcifica para formar um cisto. No tecido não estriado,
como coração e cérebro, as larvas não se calcificam. Elas morrem e se
desintegram. O cisto persiste por vários anos. Um verme-fêmea produz
aproximadamente 1500 larvas. O homem é o hospedeiro terminal. O
reservatório inclui a maioria dos animais carnívoros e onívoros (Figura
2 e 4).
Sintomas
Sintomas da
triquinose dependem da severidade da infecção: infecções amenas podem
ser assintomáticas. Um bolus de infecção grande produz sintomas de
acôrdo com a severidade e estário da infecção e dos órgãos envolvidos
(Tabela 1).
Patologia e
Imunologia
A
patogênese da triquinela é devida à presença de grande numero de larvas
em músculos vitais e a reação do hospedeiro aos metabólitos larvais. As
fibras do músculo tornam-se aumentadas, edematosas e deformadas. Os
músculos paralizados são infiltrados por neutrófilos, eosinófilos e
linfócitos. A
esplenomegalia
depende do grau da infecç]ao. O verme induz uma resposta de IgE forte
que, em associação com eosinófilos, contribui para a morte do parasita.
Diagnose
O
diagnóstico é baseado nos sintomas, história recente de alimentação por
carne crua ou mal cozida e achados laboratoriais (eosinofilia, aumento
de creatina fosfoquinase sérica e de lactato desidrogenase e anticorpos
anti-T. spiralis).
Tratamento e
Controle
Esteróides são usados para o tratamento de sintomas inflamatórios e
Mebendazol é usado para eliminar os vermes. A eliminação da infecção
pelo parasita em porcos e cozimento adequado da carne são as melhores
maneiras de evitar a infecção.
|
| |
Figura
4

 Larvas encistadas de triquinela em tecido muscular comprimido. A larva
enrolada pode ser vista dentro dos cistos. CDC
DPDx Parasite Image Library
Larvas encistadas de triquinela em tecido muscular comprimido. A larva
enrolada pode ser vista dentro dos cistos. CDC
DPDx Parasite Image Library

 Larvas de triquinela liberadas dos cistos, tipicamente enroladas;
comprimento: .8 a 1 mm. Urso do Alasca. CDC
DPDx Parasite Image Library
Larvas de triquinela liberadas dos cistos, tipicamente enroladas;
comprimento: .8 a 1 mm. Urso do Alasca. CDC
DPDx Parasite Image Library
 Larvas de
Trichinella spiralis em corte de músculo (H&E) e
compressão do músculo ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Larvas de
Trichinella spiralis em corte de músculo (H&E) e
compressão do músculo ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
|
| |
|
Tabela 1
Sintomatologia da triquinose |
|
Mucosa intestinal
(24-72 h) |
Circulação e músculo
(10-21 dias) |
Miocárdio
(10-21 dias) |
Cérebro e meninges
(14-28 dias) |
|
Náusea, diarréia e vômico, dor abdominal, cefaléia |
Edema, conjuntivite peri-orbital, fotofobia, febre, calafrios, sudorese,
dor muscular, espasmo, eosinofilia |
Dor no peito, taquicardia, mudanças no ECG, edema das extremidades,
trombose vascular |
Cefaléia (supraorbital), vertigem, zumbido no ouvido, surdez, apatia
mental, delírio, coma, perda de reflexos |
|
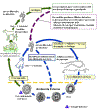
| Figura 5
 Ciclo de vida de Trichuris trichiura
Ciclo de vida de Trichuris trichiura
Os ovos não embrionados são eliminados nas fezes (1). No solo, os ovos
se desenvolvem em um estágio de 2 células (2), um estágio avançado de
clivagem (3), e depois eles se embrionam (4); os ovos se tornam
infectivos em 15 a 30 dias. Após a ingestão (mãos ou alimentos
contaminados pelo solo), os ovos eclodem no intestino delgado, e liberam
larvas (5) que maturam e se estabelecem como adultos no cólon (6). Os
vermes adultos (com aproximadamente 4 cm de comprimento) vivem no cecum
e cólon ascendente. Os vermes adultos são fixados naquele local, com as
porções anteriores ancoradas na mucosa. As fêmeas começam a postura 60
a 70 dias após a infecção. Vermes-fêmeas no cecum põem entre 3.000 e
20.000 ovos por dia. O período de vida dos adultos é de 1 ano. CDC
DPDx Parasite Image Library |
Trichuris
trichiura (tricocéfalos)
Epidemiologia
Trichiuríase é uma doença tropical de crianças (5 a 15 anos) na Asia
rural (65% dos 500 - 700 milhões de casos). Entretanto, é encontrada nas
duas Americas, principalmente na América do Sul e está concentrada em
famílias e grupos com hábitos sanitários deficientes.
Morfologia
O organismo
feminino tem 50 mm de comprimento com um diâmetro anterior menor (100
micrometros de diâmetro) e uma parte posterior mais espessa (500
micrômetros de diâmetro). O macho é menor e tem uma extremidade
posterior enrolada. Os ovos de Trichuris têm forma oval como bola de
futebol americano e tem um plugue em ambas as extremidades.
Ciclo de vida
A infecção
ocorre pela ingestão de ovos embrionados do solo. A larva escapa da
casca na parte superior do intestino delgado e penetra no vilus onde
permanece por 3 a 10 dias. Ao atingir a adolescência, as larvas passam
para o cecum e penetram na mucosa. Elas atingem a idade de ovoposição em
30 a 90 dias de infecção, produzem 3.000 a 10.000 ovos por dia e vivem 5
a 6 anos. Os ovos eliminados pelas fezes se embrionam em solo húmido em
2 a 3 semanas (Figura 5 e 6). Os ovos são menos resistentes à
dessecação, calor e ao frio do que os ovos de áscaris. O embrião morre
sob dessecação a 37 graus C em 15 minutos. Temperaturas de 52 graus C e
-9 graus C são letais.
Sintomas
Os sintomas
são grandemente determinados pela presença do verme: menos de 10 vermes
são assintomáticos. Infecções maiores (ex. Tricuiuríase massiva
infantil) são caracterizadas por diarréia mucosa e sanguinolenta profusa
e crônica com dores abdominais e prolapso de reto edematoso. A infecção
pode resultar em desnutrição, perda de peso e anemia e às vezes a morte.
Diagnóstico
Diagnose é
baseada nos sintomas e na presença de ovos nas fezes (50 a 55 x 20 a 25
micrômetros).
Tratamento e
Controle
Mebendazol, 200 mg, para adultos e 100 mg para crianças, durante 3 dias
é suficiente. Infecções associadas devem ser tratadas adequadamente.
Melhoria dos hábitos de higiene e condições sanitárias são em geral
eficientes no controle.
|
| |
Figura
6
 Ovo de Trichuris trichiura visto em montagen líquida. As características
diagnósticas são: uma forma típica de barril com dois plugues nos polos,
que não se coram, tamanho: 50-54 µm por 22-23 µm. A camada externa da
casca do ovo é amarela amarronzada (contrastando com os plugues polares
claros). O ovo é não embrionado, e como ovos eles são eliminados pelas
fezes. CDC
DPDx Parasite Image Library
Ovo de Trichuris trichiura visto em montagen líquida. As características
diagnósticas são: uma forma típica de barril com dois plugues nos polos,
que não se coram, tamanho: 50-54 µm por 22-23 µm. A camada externa da
casca do ovo é amarela amarronzada (contrastando com os plugues polares
claros). O ovo é não embrionado, e como ovos eles são eliminados pelas
fezes. CDC
DPDx Parasite Image Library
 Macho e fêmea adultos de
Trichuris trichiura ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Macho e fêmea adultos de
Trichuris trichiura ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
 Ovos de
Trichuris trichiura não corado e corado com
hematoxicilina ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Ovos de
Trichuris trichiura não corado e corado com
hematoxicilina ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
|
| Figura 7
Ciclo de vida do Enterobius vermicularis
Ovos são depositados nas pregas perianais (1). Auto-infecção ocorre
pela transferência de ovos infectivos para a bôca com mãos que coçaram a
área perianal (2). Contaminação pessoa-a-pessoa pode ocorrer através da
manipulação de vestuário contaminado ou roupa de cama. Oxiuríase (ou
enterobiose) pode também ser adquirida através de superfícies no
ambiente que estejam contaminadas com ovos de oxiúros (ex. curtinas,
carpetes). Um pequeno número de ovos pode flutuar no ar e ser inalado.
Estes serão deglutidos e seguem o mesmo desenvolvimento dos ovos
ingeridos. Após a ingestão de ovos infectivos, a larva eclode no
intestino delgado (3) e os adultos se estabelecem no cólon (4). O
intervalo de tempo entre a ingestão de ovos infectivos e a ovoposição
pelas fêmeas adultas é de cêrca de um mês. A duração da vida de adultos
é de cêrca de dois meses. Fêmeas grávidas migram noturnamente fora do
ânus e depositam ovos ao rastejarem pela pele da área perianal (5). A
larva contida dentro dos ovos se desenvolve (os ovos se tornam
infectivos) em 4 a 6 horas em condições optimas (1). Retroinfecção, ou
a migração de larvas recém eclodidas na pele anal de volta para o reto
pode ocorrer, mas a frequência em que isso ocorre é desconhecida.
CDC |
Enterobius
vermicularis
(oxiúros)
Epidemiologia
Enterobiose
é de longe a infecção helmíntica mais comum nos Estados Unidos (18
milhões de casos a qualquer tempo). A infecção no mundo inteiro é de
cerca de 210 milhões. É uma doença urbana de crianças em ambientes
superpopulados (escolas, creches, etc.) Adultos podem se contaminar
pelas crianças. A incidência em brancos é muito maior do que em negros.
Morfologia
O
verme-fêmea mede 8 mm x 0.5mm; o macho é menor. Os ovos (60 micrômetros
x 27 micrômetros) são ovóides mas assimetricamente achatados em um lado.
Ciclo de Vida
A infecção
ocorre quando ovos embrionados são ingeridos a partir do meio ambiente,
com alimentos ou contato com as mãoes. A larva embrionária eclode no
duodeno e atinge a adolescência no jejuno e ílio superior. Os vermes
adultos descem para o baixo íleo, cecum e cólon e vivem lá por 7 a 8
semanas. As fêmeas grávidas, contendo mais de 10.000 ovos migram à
noite, para a região perianal e depositam ovos aí. Os ovos maturam em um
ambiente oxigenado e úmido e são infecciosos 3 a 4 horas mais tarde.
Infecção homem-para-homem e autoinfecção são comuns (Figura 7 e 8). O
homem é o único hospedeiro.
Sintomas
Enterobiose
é relativamente inócua e raramente produz lesões sérias. O sintoma mais
comum é irritação perianal, perineal e vaginal provocada pela migração
da fêmea. O prorido leva a insônia e nervosismo. Em alguns casos
sintomas gastrointestinais podem se desenvolver (dor, náusea, vômitos,
etc.). O stress psicológico de dona-de-casa consciente, complexo de
culta, e desejo de esconder a infecção de seus amigos e de sua sogra (em
certas culturas) é talvez o trauma mais importante deste parasita
pruriginoso persistente.
Diagnóstico
O
diagnóstico é feito pela pesquisa de vermes adultos ou ovos na área
perianal, particularmente à noite. Uma fita adesiva tipo scotch-test ou
uma palheta para coleta de oxiúros aão usados para obter ovos.
Tratamento e
Controle
Duas doses
(10 mg/kg; maximo de 1g cada) de pamoato de pirantel com intervalo de
duas semanas promove um alto índice de cura. Mebendazol é uma
alternativa. A família inteira deve ser tratada, para evitar reinfecção.
Roupas íntimas e de cama devem ser esterilizadas entre as duas doses de
tratamento. Limpeza pessoal é a forma de prevenção mais eficiente.
|
| |
Figura
8
 Adultos de
Enterobius vermicularis macho e fêmea ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Adultos de
Enterobius vermicularis macho e fêmea ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
 Adultos de
Enterobius vermicularis em corte de apêndice (H&E) ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Adultos de
Enterobius vermicularis em corte de apêndice (H&E) ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
A
 B
B
 C
C
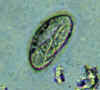
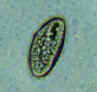
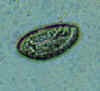
Três ovos de
Enterobius vermicularis coletados do mesmo paciente
em um tubo de Falcon de sistema de teste de diagnóstico (palheta coberta
com material adesivo), examinado diretamente em microscopia ótica. As
características diagnósticas são: tamanho 50-60 µm por 20-32 µm; forma
alongada típica, com um lado convexo e um lado achatado; casca sem cor
(aqui vista comu um halo ao redor do ovo). O ovo em A contém um embrião,
enquanto em B e C contém larvas mais diferenciadas, que são tipicamente
enroladas.
CDC
DPDx
Parasite Image Library
|
| Figura
9
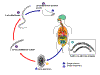
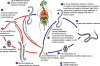 O ciclo de vida do Strongyloides é complexo entre os helmintos
com sua alternância de gerações entre ciclos de vida livre e
parasíticas, e seu potencial para autoinfecção e multiplicação dentro do
hospedeiro. Dois tipos de ciclos existem:
O ciclo de vida do Strongyloides é complexo entre os helmintos
com sua alternância de gerações entre ciclos de vida livre e
parasíticas, e seu potencial para autoinfecção e multiplicação dentro do
hospedeiro. Dois tipos de ciclos existem:
Ciclo de vida livre: A larva rabditiforme eliminada pelas fezes (1) (ver
“Ciclo parasítico” abaixo) podem realizar duas mudas e se tornarem
larvas filariformes infectivas (desenvolvimento direto) (6) ou realizar
quatro mudas e se tornarem machos e fêmeas adultos de vida livre (2) que
se cruzam e produzem ovos (3) dos quais eclodem larvas rabditiformes
(4). Estas últimas por sua vez podem se desenvolver (5) em uma nova
geração de adultos de vida livre (conforme representado em (2), ou em
larvas infectivas filariformes (6). As larvas filariformes penetram na
pele do hospedeiro humano para iniciar o ciclo parasítico (ver abaixo)
(6).
Ciclo parasítico: Larvas filariformes em solo contaminado penetram na
pele humana (6), e são transportadas para os pulmões onde elas penetram
nos espaços alveolares; elas são levadas pela árvore bronquial para a
faringe, são deglutidas e daí atingem o intestino delgado (7). No
intestino delgado elas realizam duas mudas e se tornam vermes-fêmeas
adultas (8). As fêmeas vivem ancoradas no epitélio do intestino delgado
e produzem ovos por partenogênese (9), que resultam em larvas
rabditiformes. A larva rabdiforme pode ser eliminada pelas fezes (1)
(ver "Ciclo de vida livre" acima), ou pode causar autoinfecção (10). Na
autoinfecção, as larvas rabditiformes se tornam larvas infectivas
filariformes, que podem penetrar na mucosa intestinal (autoinfecção
interna) ou a pele da área perianal (autoinfecção externa); em qualquer
caso, as larvas filariformes sequem a rota previamente descrita, sendo
sucessivamente levada para os pulmões, para a árvore bronquial, para a
faringe e para o intestino delgado onde elas maturam para a forma
adulta; ou elas se disseminam amplamente no corpo. Até o presente, a
ocorrência de autoinfecção em humanos com infecções helmínticas é
reconhecida somente em infecções por Strongyloides stercoralis e
Capillaria philippinensis. No caso de Strongyloides, a
autoinfecção pode explicar a possibilidade de infecções persistentes por
muitos anos em pessoas que não estiveram em área endêmica e de
hiperinfecções em indivíduos imunodeprimidos CDC
DPDx Parasite Image Library |
Strongyloides stercoralis
(Nematelminto)
Epidemiologia
Infecção por
nematelmintos, também conhecida como diarréia da Cochinchina, estimada em 50 a
100 milhões de casos no mundo inteiro, é uma infecção de áreas tropicais e
subtropicais com condições sanitárias deficientes. Nos Estados Unidos, é
prevalente no Sul e entre os Portoriquenhos.
Morfologia
O tamanho e forma do
nematelminto varia dependendo de se o parasita é de vida livre. A fêmea do
parasita é maior (2.2 mm x 45 micrômetros) do que o verme de forma livre (1 mm x
60 micrômetros) (figura 10). Os ovos, quando posto medem 55 micrômetros por 30
micrômetros.
Ciclo de vida
(figura 9)
A larva infectiva de
S. stercoralis penetra a pela do homem, entra na
circulação venosa e passa pelo lado direito do coração para os pulmões, onde
penetra nos alvéolos. Daí, os parasitas adolescentes ascendem para a glote, são
degludidas, e atingem a parte superior do intestino delgado, onde se desenvolvem
em adultos. Fêmeas poedeiras se desenvolvem em 28 dias após a infecção. Os ovos
na mucosa intestinal, eclodem e se desenvolvem em larvas
rabditiformes
no homem. Essas larvas podem penetrar através da mucosa e voltam ao ciclo para a
circulação sanguínea, pulmões, glote e duodeno e jejuno; assim elas continuam o
ciclo de autoinfecção. Alternativamente, elas são eliminadas pelas fezes, se
desenvolvem em formas
filariformes
infectivas e entram em outro hospedeiro para completar o ciclo direto. Se não
encontrar um hospedeiro adequado, as larvas maturam em vermes de vida livre e
põem ovos no solo. Os ovos eclodem no solo e produzem larvas rabditiformes que
se desenvolvem em larvas filariformes infectivas e entram em um novo hospedeiro
(ciclo indireto), ou maturam em formas adultas do verme para repetir o ciclo de
vida livre.
Sintomas
Infecções amenas são
assintomáticas. A penetração pela pele provoca prurido e bolhas vermelhas.
Durante a migração, os organismo provocam pneumonia bronquial verminosa e, no
duodeno, elas provocam dor epigástrica mediana com sensação de queimor e
estômago delicado, acompanhados de náusea e vômito. Pode ocorrer alternância de
diarréia e constipação. Infecções intensas e crônicas levam a anemia, perda de
peso e disenteria sanguinolenta crônica. Infecção bacteriana secundária da
mucosa lesada pode produzir complicações sérias.
Diagnose
A presença de larvas
rabditiformes livres (figura 10) nas fezes é uma forma diagnóstica. Cultura de
fezes de 24 horas produz larvas filariformes.
Tratamento e controle
Ivermectin ou
tiabendazol pode ser usado eficientemente. Infecções diretas e indiretas são
controladas pela melhoria nas condições de higiene e a autoinfecção é controlada
pela quimioterapia.
|
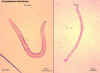
Figura 10
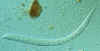 Strongyloides stercoralis
Strongyloides stercoralis
A estrutura esofageana é claramente visível nesta larva; ela consiste de
uma porção anterior claviforme; uma constrição pós-mediana; e um bulbo
posterior CDC
DPDx Parasite Image Library
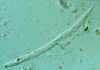 Strongyloides
stercoralis
Strongyloides
stercoralis
Note o primórdio genital proeminente na seção mediana da larva; note
também o cisto de Entamoeba coli próximo da cauda da larva. CDC
DPDx Parasite Image Library
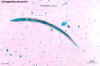 Larva rabdiforme de
Strongyloides stercoralis ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Larva rabdiforme de
Strongyloides stercoralis ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
|
| Figura
11
 Ciclo de vida dos Necator/Ancilóstomos.
Ciclo de vida dos Necator/Ancilóstomos.
Os ovos são eliminados pelas fezes (1), e em condições favoráveis
(humidade, calor, sombra), as larvas eclodem em 1 a 2 dias. A larva
rabdiforme liberada cresce nas fezes e/ou no solo (2), e após 5 a 10
dias (e duas mudas) elas se tornam larvas filariformes (terceiro
estágio) que são infectivas (3). Essas larvas infectivas podem
sobreviver 3 a 4 semanas em condições ambientais favoráveis. Com o
contato com o hospedeiro humano, as larvas penetram na pele e são
levadas pelas veias para o coração e daí para os pulmões. Elas penetram
nos alvéolos pulmonares, ascendem a árvore bronquial para a faringe, e
são deglutidas (4). As larvas atingem o intestino delgado, onde residem
e maturam em adultos. Vermes adultos vivem no lúmen do intestino
delgado, onde se ligam à parede intestinal com perda sanguínea do
hospedeiro resultante (5). A maioria dos vermes adultos são eliminados
em 1 a 2 anos, mas os records de longevidade chegam a vários anos.
Algumas larvas de A. duodenale, após penetração pela pele do
hospedeiro, podem se tornar dormentes (no intestino ou músculo). Além
disso, a infecção pelo A. duodenale pode provavelmente ocorrer
também pela rota oral e transmamária. N. americanus, entretanto,
requer uma fase de migração transpulmonar. CDC
DPDx Parasite Image Library
|
Necator
americanus
e Ancylostoma duodenalis (Hookworms=vermes com gancho)
Epidemiologia
Esses “hookworms” (aqui referidos como vermes Necator/Ancilóstomos)
parasitam mais de 900 milhões de pessoas no mundo inteiro e causam
perda diária de sangue de 7 milhões de litros. A ancilostomíase é a
infecção mais comum e perde apenas para ascaridíase entre as
infecções por vermes parasitários. N. americanus (do novo
mundo) é mais comum nas Americas, central e sudeste da África, Ásia
meridional, Indonesia, Austrália e Ilhas do Pacífico.
A. duodenale (do novo mundo) é a espécie dominante na região
Mediterrânea e norte da Asia.
Morfologia
Fêmeas
adultas de Necator/Ancylostoma medem cerca de 11 mm x 50
micrômetros. Machos são menores. A extremidade anterior de N.
americanus é dotada de um par de placas cortantes curvadas,
enquanto que o A. duodenale é equipado com um ou mais pares
de dentes. Os vermes dos hookworms medem 60 micrômetros x 35
micrômetros.
Ciclo de
vida
(figura 11 e
12)
O ciclo de vida dos Necator/Ancylostomas é idêntico ao do das larvas
migrans, exceto pelo fato de os primeiros não serem capazes de uma
vida-livre ou ciclo de autoinfecção. Além disso, A. duodenale
pode infectar também pela rota oral.
Sintomas
Os
sintomas da infecção por Necator/Ancylostomas dependem do local onde
o verme está presente (Tabela 2) e do desconfôrto causado pela
presença dos vermes. Infecção amena pode passar desapercebida.
|
Tabela 2. Aspectos clínicos da doença provocada pelos hookworm |
|
Site |
Sintomas |
Patogenia |
|
Dérmica |
Eritema local, máculas, pápulas (urticária) |
Invasão cutânea e migração subcutânea da larva |
|
Pulmonar |
Bronquite, pneumonite e, às vezes, eosinofilia |
Migração das larvas através dos pulmões, brônquios e traquéia |
|
Gastro- intestinal |
Anorexia, dor epigástrica e hemorragia intestinal |
Ligação dos vermes adultos e lesão na mucosa intestinal superior |
|
Hematológica |
Deficiência de ferro, anemia, hipoproteinemia, edema, falha cardíaca |
Perda sanguínea intestinal |
Diagnose
A
diagnose é feita pela identificação dos ovos de Necator/Ancylostoma
em fezes frescas ou preservadas. Espécies de Necator/Ancylostoma não
podem ser distinguíveis pela morfologia dos ovos.
Tratamento e controle
Mebendazol, 200 mg, para adultos e 100 mg para crianças, por 3 dias
é eficiente. Higiene é o principal método de controle: Saneamento é
o principal método de controle: Tratamento sanitário do material
fecal e evitar o contato com material fecal infectado.
|
|
|
Figura 12
Ovos de Necator/Ancylostoma examinados em montagem líquida (ovos de
Ancylostoma duodenalis e Necator americanus não podem ser
distinguidos morfologicamente). Características diagnósticas: Tamanho
57-76 µm por 35-47 µm, forma oval ou elipsoidal, casca fina. O embrião
em B iniciou a divisão celular e está em um estágio de desenvolvimento
de gástrula inicial. CDC
DPDx Parasite Image Library
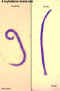
Adulto de
Ancylostoma duodenalis macho e fêmea ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.

Extremidade
anterior de
Necator americanus fêmea adulta ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.

Fêmea
adulta de Necator americanus, extremidades anterior e posterior
©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
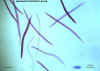
Larvas
filariformes de hookworm
©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Macho
adulto de Necator americanus, extremidade posterior
©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão.
Ovos
de hookworm
©
Dr Peter Darben,
Queensland Universidade de Tecnologia de Queensland, coleção de
parasitologia clínica. Usado com permissão.
|
| |
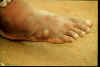
Dracunculus medinensis (Verme da Guiné; Serpente de fogo)
Dracunculiase vem do Latin: aflição por pequenos dragões. O nome
comum "verne da Guiné" resulta da primeira observação deste parasita
pelos Europeus na costa da Guiné no Oeste da África no século 17. A
infecção provoca um queimor, sensação dolorosa que leva à doença chamada
de serpente de fogo.
|
|
|
Epidemiologia
Têm ocorrido
esforços dramáticos para erradicar o Dracunculus. CDC estima que em
1986 houveram 3.5 milhões de casos no mundo inteiro. Entretanto, no final de
2007, houveram menos do que 10.000 casos registrados em cinco nações da
Africa: Sudão, Gana, Nigéria, Niger e Mali, e em Junho de 2008, os casos
foram reduzidos em mais de 50 por cento quando comparados com o mesmo
período de 2007. A expectativa é de que a doença do verme da Guiné seja a
próxima doença depois da varíola a ser erradicada e presentemente deve
existir uns 1.000 casos no mundo inteiro apenas.
Morfologia
A fêmea adulta
do verme mede 50-120 cm por 1 mm e o macho tem a metade deste tamanho.
Ciclo de vida
A infecção é
causada pela ingestão de água contaminada com crustáceos (copepodas)
infectados com larvas. A larva rabditiformes penetram no trato digestivo
humano, se alojam no tecido conjuntivo frouxo e maturam em forma adulta em
10 a 12 semanas. Em cerca de um ano, a fêmea grávida migra para os tecidos
subcutâneos dos órgãos que normalmente estão em contato com a água e
descarrega as larvas na água (figura 13A). As larvas são coletadas pelo
crustáceo, no qual elas se desenvolvem em formas infectivas em 2 a 3
semanas.
Sintomas
Se o verme não
atinge a pele, ele morre e causa uma reação pequena. No tecido superficial,
ele libera uma substância tóxica que produz uma reação inflamatória local na
forma de uma bolha estéril com exsudação serosa. O verme fica em um túnel
subcutâneo com sua extremidade posterior abaixo da bolha, que contém um
fluido amarelo claro. O trajeto do túnel é marcado com uma
calosidade
e edema. Contaminação da bolha produz abcessos,
celulite,
ulceração extensiva e necrose.
Diagnose
O diagnóstico é
feito a partir da bolha local, do verme ou larva. O contôrno do verme sob a
pele é revelado pela luz refletida.
Tratamento
O tratamento
inclui a extração do verme da Guiné adulto enrolando-o alguns centímetros
por dia ou preferencialmente por meio de múltiplas incisões cirúrgicas sob
anestesia local. Nenhuma droga é eficiente para matar o verme. A proteção da
água de beber contra contaminação pelo crustáceo e larvas são medidas de
prevenção eficientes.
|
| Figura 13
A
B
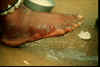 A, B: O Verme da Guiné fêmea induz uma dolorosa bôlha (A); após a
rotura da bôlha, o verme emerge como um filamento esbranquiçado (B) no
centro de uma úlcera dolorosa que é frequentemente contaminada por
infecções secundárias. (Imagens contribuídas pelo Global 2000/The Carter
Center, Atlanta, Georgia). CDC
A, B: O Verme da Guiné fêmea induz uma dolorosa bôlha (A); após a
rotura da bôlha, o verme emerge como um filamento esbranquiçado (B) no
centro de uma úlcera dolorosa que é frequentemente contaminada por
infecções secundárias. (Imagens contribuídas pelo Global 2000/The Carter
Center, Atlanta, Georgia). CDC
C

Verme de Dracunculus medinensis enrolado em palito de fósforo.
Este helminto é gradualmente retirado do corpo ao se enrolar no palito
CDC/Dr. Myron Schultz |
| |
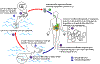 Figura 13A
Figura 13A
Humanos se tornam infectados ao beber água não filtrada contendo copépodas
(pequenos crustáceos) que estão infectados com larvas de D. medinensis
 .
Após a ingestão, os copépodas morrem e liberam as larvas, que penetram no
estômago do hospedeiro e na parede intestinal e entram na cavidade abdominal e
espaço retroperitoneal .
Após a ingestão, os copépodas morrem e liberam as larvas, que penetram no
estômago do hospedeiro e na parede intestinal e entram na cavidade abdominal e
espaço retroperitoneal
 .
Após a maturação em adultos e copulação, os vermes machos morrem e as fêmeas
(comprimento: 70 a 120 cm) migram nos tecidos subcutâneos para a superfície da
pele .
Após a maturação em adultos e copulação, os vermes machos morrem e as fêmeas
(comprimento: 70 a 120 cm) migram nos tecidos subcutâneos para a superfície da
pele
 .
Aproximadamente um ano após a infecção, as fêmeas induzem uma bolha na pele,
geralmente na extremidade distal inferior, que rompe. Quando esta lesão entra em
contato com a água, contato esse desejado pelo paciente que procura alívio para
o desconfôrto local, as fêmeas emergem e liberam larvas .
Aproximadamente um ano após a infecção, as fêmeas induzem uma bolha na pele,
geralmente na extremidade distal inferior, que rompe. Quando esta lesão entra em
contato com a água, contato esse desejado pelo paciente que procura alívio para
o desconfôrto local, as fêmeas emergem e liberam larvas
 .
As larvas são ingeridas por um copépoda .
As larvas são ingeridas por um copépoda
 e após duas semanas (e duas mudas) terão se desenvolvido em larvas infectivas
e após duas semanas (e duas mudas) terão se desenvolvido em larvas infectivas
 .
A ingestão dos copépodas fecham o ciclo .
A ingestão dos copépodas fecham o ciclo
 CDC
DPDx Parasite
Image Library
CDC
DPDx Parasite
Image Library
|
| Figura
14
 Ovos de Toxocara canis. Esses ovos são eliminados nas fezes de
cachorros, especialmente de animais jovens. Humanos não produzem ou
excretam ovos, e portanto ovos não são um achado diagnóstico na
toxocaríase humana! O ovo à esquerda está fertilizado mas ainda não
embrionado, enquanto que o ovo da direita contém uma larva bem
desenvolvida. Este último será infectivo se ingerido por um humano
(frequentemente, uma criança).
Ovos de Toxocara canis. Esses ovos são eliminados nas fezes de
cachorros, especialmente de animais jovens. Humanos não produzem ou
excretam ovos, e portanto ovos não são um achado diagnóstico na
toxocaríase humana! O ovo à esquerda está fertilizado mas ainda não
embrionado, enquanto que o ovo da direita contém uma larva bem
desenvolvida. Este último será infectivo se ingerido por um humano
(frequentemente, uma criança).
CDC
DPDx Parasite Image Library
 Ôvo de Toxocara canis (Vermes Cilíndricos Caninos), embrionado
Ôvo de Toxocara canis (Vermes Cilíndricos Caninos), embrionado
©
Dr Peter Darben,
coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado
com permissão. |
Toxocara
canis
e T. catti (larva migrans visceral)
Estes são vermes de cães e gatos mas eles podem infectar humanos e
causar danos em órgãos viscerais. Os ovos das fezes de animais
infectados são deglutidos pelo homem e eclodem no intestino. As larvas
penetram na mucosa, entram na circulação e são levados ao fígado,
pulmões, olhos e outros órgãos onde provocam necrose inflamatória. Os
sintomas são devidos à reação inflamatória no local da infecção. A
consequência mais séria da infecção é a perda da visão se o verme se
localiza no ôlho. O tratamento inclui Mebendazol para eliminar o verme e
prednisona para os sintomas inflamatórios. Evitar cães e gatos
infectados é a melhor prevenção (figura 14 e 15).
|
Figure
15
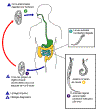
 Ciclo de Vida de Toxocara
Ciclo de Vida de Toxocara
Toxocara canis faz seu ciclo de vida em cães, com humanos adquirindo a
infecção como hospedeiros acidentais. Após a ingestão pelos cães, os
ovos infectivos produzem larvas que penetram nas paredes do intestino e
migram para vários tecidos, onde encistam se o cão tiver mais de 5
semanas de idade. Em cães mais jovens as larvas migram através dos
pulmões, árvore bronquial e esôfago; vermes adultos desenvolvem e fazem
a postura no intestino delgado. Em cães mais velhos, os estágios
encistados são reativados durante a gravidez, e infectam pelas rotas
transplacentária e transmamária os filhotes, em cujo intestino delgado
vermes adultos se estabelecem. Assim, ovos infectivos são excretados
pelas cadelas e filhotes infectados. Humanos são hospedeiros paratênicos
que se tornam infectados ao ingerirem ovos infectivos em solo
contaminado. Após a ingestão, os ovos produzem larvas que penetram na
parede intestinal e são levados pela circulação a uma variedade de
tecidos (fígado, coração, pulmões, cérebro, músculo, olhos). Enquanto as
larvas não realizam nenhum desenvolvimento nesses locais, elas podem
causar reações locais severas que são a base da toxocaríase.
CDC
|
Figura
16
 Macho adulto e fêmea de Ancylostoma brasiliense ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland. Usado
com permissão.
Macho adulto e fêmea de Ancylostoma brasiliense ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland. Usado
com permissão. |
Ancylostoma
braziliensis
(larva migrans cutânea, bicho geográfico)
O bicho geográfico é predominante em muitos países tropicais e
subtropicais e nos Estados Unidos, especialmente nos estados do Golfo e
do Atlântico sul. O organismo é primariamente um verme canino e de gatos
mas as larvas filariformes em fezes animais podem infectar o homem e
causar erupções na pele. Uma vez que as larvas têm a tendência de se
mover, a erupção migra na pele ao redor do local da infecção. Os
sintomas duram o período da persistência larval que varia de 2 a 10
semanas. Uma infecção amena pode ser tratada pelo congelamento da área
envolvida. Infecções maiores são tratadas com mebendazol. A infecção
pode ser evitada pelo afastamento de água e solo contaminado com fezes
infectadas (figura 16 e 17).
|
A
B
Ovos de tênia examinados em montagem líquida (ovos de Ancylostoma
duodenale e Necator americanus não podem ser distintos
morfologicamente).
Características diagnósticas:
Tamanho 57-76 µm por 35-47 µm
Forma oval ou elipsóide
Casca fina
O embrião em B iniciou divisão celular e está em um estágio de
(gástrula) inicial. CDC
DPDx Parasite Image Library |
Figura
17
 Ovos são eliminados pelas fezes
Ovos são eliminados pelas fezes
 ,
e em condições favoráveis (humidade, calor, sombra), as larvas eclodem
em 1 a 2 dias. As larvas rabditiformes liberadas crescem nas fezes e/ou
no solo ,
e em condições favoráveis (humidade, calor, sombra), as larvas eclodem
em 1 a 2 dias. As larvas rabditiformes liberadas crescem nas fezes e/ou
no solo
 ,
e após 5 a 10 dias (e duas mudas) elas se tornam filariformes (terceiro
estágio) larvas que são infectivas ,
e após 5 a 10 dias (e duas mudas) elas se tornam filariformes (terceiro
estágio) larvas que são infectivas
 .
Essas larvas infectivas podem sobreviver por 3 a 4 semanas em condições
ambientais favoráveis. Ao contato com o hospedeiro humano, as larvas
penetram na pele e são levadas pelas veias ao coração e depois para os
pulmões. Elas penetram nos alvéolos pulmonares, ascendem pela árvore
bronquial para a faringe, e são deglutidos .
Essas larvas infectivas podem sobreviver por 3 a 4 semanas em condições
ambientais favoráveis. Ao contato com o hospedeiro humano, as larvas
penetram na pele e são levadas pelas veias ao coração e depois para os
pulmões. Elas penetram nos alvéolos pulmonares, ascendem pela árvore
bronquial para a faringe, e são deglutidos
 .
As larvas atingem o intestino delgado, onde elas residem e maturam em
adultos. Vermes adultos vivem no lúmen do intestino delgado, onde elas
se ligam à parede intestinal com resultante perda de sangue do
hospedeiro .
As larvas atingem o intestino delgado, onde elas residem e maturam em
adultos. Vermes adultos vivem no lúmen do intestino delgado, onde elas
se ligam à parede intestinal com resultante perda de sangue do
hospedeiro
 . .
A maioria dos vermes adultos são eliminados em 1 a 2 anos, mas os
records de longevidade podem atingir alguns anos.
Algumas larvas de
A. duodenale, após a penetração na pele do
hospedeiro, podem se tornar dormentes (no intestino ou no músculo). Além
disso, a infecção por A. duodenale pode provavelmente também
ocorrer pela rota oral e transmamária. N. americanus, entretanto,
requer uma fase de migração transpulmorar. CDC
DPDx Parasite Image Library
|
| |
HELMINTOS DO SANGUE E DOS TECIDOS
Os principais parasitas
do sangue e dos tecidos do homem são as microfilárias. Estas incluem
Wuchereria bancrofti e W. (Brugia) Malayi, Onchocerca volvulus,
e Loa loa (verme do ôlho).
|
|
|
Wuchereria
bancrofti
e W. (Brugia) malayi (elefantíase)
Epidemiologia
W. bancrofti
(figura 18) é estritamente um patógeno humano e é distribuido em
áreas tropicais no mundo inteiro, enquanto que B. malayi
(figura 19) infectas vários animais selvagens e domésticos e á
restrito ao Sudeste da Asia. Mosquitos são vetores para ambos os
parasitas.
Morfologia
Esses dois organismos são muito similares em morfologia e nas
doenças que eles provocam (figura 18 e 19). Fêmeas adultas de W.
bancrofti encontradas em linfonodos e canais linfáticos medem 10
cm x 250 micrômetros, enquanto que machos têm apenas a metade do
tamanho. Microfilárias encontradas no sangue medem apenas 260
micrômetros x 10 micrômetros. Adultos de B. malayi têm apenas
a metade do tamanho da W. bancrofti mas suas microfilárias
são apenas discretamente menores do que W. bancrofti.
Ciclo de
vida
As
larvas filariformes entram no corpo humano durante a picada do
mosquito e migram para vários tecidos. Neste local elas levam até um
ano para maturar e produzirem microfilárias que migram para os
canais linfáticos (figura 19) e, à noite,entram na circulação
sanguínea. Os mosquitos são infectados durante um repasto sanguíneo.
A microfilária cresce 4 a 5 vezes no mosquito em 10 a 14 dias e se
tornam infectivas para o homem.
Sintomas
Os
sintomas incluem linfadenite e febre alta recorrente a cada 8 a 10
semanas, que dura 3 a 7 dias. Há infadenite progressiva devido a uma
resposta inflamatória ao parasita alojado nos canais linfáticos e
tecidos. À medida que o verme morre, a reação continua e produz um
granuloma fibro-proliferativo que obstrui os canais linfáticos e
provoca linfedema e elefentíase (figura 20). A pele distendida é
susceptível a lesões traumáticas e infecções. A microfilária provoca
eosinofilia
e alguma esplenomegalia. Nem todas as infecções levam à elefantíase.
A prognose, na ausência de elefantíase, é boa.
Diagnose
Diagnose é baseada na história de picada de mosquitos em áreas
endêmicas, achados clínicos e presença da microfilária em amostra de
sangue coletada à noite.
Tratamento e controle
A
dietilcarbamazina mata os vermes adultos ou esterilizam as fêmeas. É
dada 2 mg/kg oralmente por 14 dias. Esteróides ajudam a aliviar os
sintomas inflamatórios.
Climas mais frios
reduzem a reação inflamatória.
|
| |
|
|
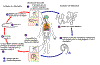 Figura 18A
Figura 18A
Diferentes espécies dos seguintes gêneros de mosquitos são vetores da
filaríase por W. bancrofti dependendo da distribuição
geográfica. Entre eles estão: Culex (C. annulirostris,
C. bitaeniorhynchus, C. quinquefasciatus, e C. pipiens);
Anopheles (A. arabinensis, A. bancroftii, A.
farauti, A. funestus, A. gambiae, A. koliensis,
A. melas, A. merus, A. punctulatus e A.
wellcomei); Aedes (A. aegypti, A. aquasalis, A. bellator,
A. cooki, A. darlingi, A. kochi,
A. polynesiensis, A. pseudoscutellaris, A. rotumae,
A. scapularis, and A. vigilax); Mansonia (M.
pseudotitillans, M. uniformis); Coquillettidia (C.
juxtamansonia). Durante um repasto sanguíneo, um mosquito infectado
introduz larvas de filária em terceiro-estágio na pele do hospedeiro
humano, onde elas penetram pela lesão da mordida
 .
Elas se desenvolvem em adultos que residem comumente nos vasos
linfáticos .
Elas se desenvolvem em adultos que residem comumente nos vasos
linfáticos
 .
Os vermes-fêmeas medem 80 a 100 mm de comprimento e 0.24 a 0.30 mm de
diâmetro, enquanto os machos medem cerca de 40 mm por 1 mm. Adultos
produzem microfilárias medindo 244 a 296
μm
por 7.5 a 10
μm,
que são cobertas e têm periodicidade noturna, exceto as microfilárias do
Pacífico Sul, que não têm periodicidade marcante. As microfilárias
migram para os vasos linfáticos e sanguíneos movendo-se ativamente
através da linfa e sangue .
Os vermes-fêmeas medem 80 a 100 mm de comprimento e 0.24 a 0.30 mm de
diâmetro, enquanto os machos medem cerca de 40 mm por 1 mm. Adultos
produzem microfilárias medindo 244 a 296
μm
por 7.5 a 10
μm,
que são cobertas e têm periodicidade noturna, exceto as microfilárias do
Pacífico Sul, que não têm periodicidade marcante. As microfilárias
migram para os vasos linfáticos e sanguíneos movendo-se ativamente
através da linfa e sangue
 .
Um mosquito ingere a microfilária durante um repasto sanguíneo .
Um mosquito ingere a microfilária durante um repasto sanguíneo
 .
Após a ingestão, as microfilárias perde suas bainhas e algumas delas
encontram seus caminhos através das paredes do proventrículo e porção
cardíaca do intestino médio do mosquito e atingem os músculos torácicos .
Após a ingestão, as microfilárias perde suas bainhas e algumas delas
encontram seus caminhos através das paredes do proventrículo e porção
cardíaca do intestino médio do mosquito e atingem os músculos torácicos
 .
Aí as microfilárias se desenvolvem no primeiro
estágio larval .
Aí as microfilárias se desenvolvem no primeiro
estágio larval
 e subsequentemente em larvas infectivas de terceiro estágio
e subsequentemente em larvas infectivas de terceiro estágio
 .
O terceiro estágio infectivo larval migra através do
hemocele do mosquito para a probóscide do mosquito .
O terceiro estágio infectivo larval migra através do
hemocele do mosquito para a probóscide do mosquito
 e
pode infectar outro humano quando o mosquito faz repasto sanguíneo
e
pode infectar outro humano quando o mosquito faz repasto sanguíneo
 .
CDC
DPDx
Parasite Image Library .
CDC
DPDx
Parasite Image Library
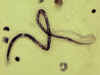 Figura 18B
Figura 18B
Microfilária de Wuchereria bancrofti, de um paciente visto no Haiti.
Preparação em gôta espêssa corada com hematoxilina. A microfilária é
coberta por uma bainha, seu corpo é levemente curvado, e a cauda é
ponteaguda. A coluna nuclear (as células que constituem o corpo da
microfilária) é frouxamente empacotado, as células podem ser
visualizadas individualmente e não passam da ponta da cauda. A bainha é
levemente corada por hematoxilina. CDC
DPDx Parasite Image Library
 Figura 18C
Figura 18C
Microfilaria de Wuchereria bancrofti coletada por filtração com uma
membrana nucleoporo. Coloração pelo Giemsa, que não demonstra a bainha
destas espécies embainhadas (coloração por hematoxilina cora a bainha
levemente). Os poros da membrana são visíveis. CDC
DPDx Parasite Image Library
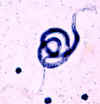 Figura 19A
Figura 19A
Microfilária de Brugia malayi. Preparação em gôta espêssa , corada com
hematoxilina. Assim como Wuchereria bancrofti, estas espécies têm uma
bainha (levemente corada com hematoxilina). Diferentemente da
Wuchereria, as microfilárias nestas espécies são mais enroladas, e a
coluna nuclear é mais densamente empacotada, impedindo a visualização
das células individuais.
CDC
DPDx
Parasite Image Library
 Figura 19B
Figura 19B
Detalhes da microfilária de Brugia malayi mostrando a cauda
ponteaguda, com um núcleo subterminal e outro terminal (mostrados como
dilatações ao nível das setas), separados por um espaço sem núcleos.
Esta é característica de B. malayi. CDC
DPDx Parasite Image Library
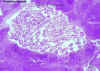 Figura 19C
Figura 19C
Adultos de Wuchereria bancrofti em corte do linfonodo (H&E) ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão
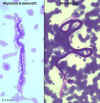 Figura
19D
Figura
19D
Microfilária de Wuchereria bancrofti em sangue periférico, coloração
pelo giemsa ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão
 Figura
19E
Figura
19E
O vetor típico para a filariose por
Brugia malayi são espécies de
mosquitos do gênero Mansonia and Aedes. Durante um
repasto sanguíneo, um mosquito infectado introduz larvas filáricas de
terceiro estágio na pele do hospedeiro humano, onde elas penetram pela
lesão da mordida
 .
Elas se desenvolvem em adultos que comumente residem nos vasos
linfáticos .
Elas se desenvolvem em adultos que comumente residem nos vasos
linfáticos  .
Os vermes adultos lembram os de
Wuchereria bancrofti mas são
menores. As fêmeas medem 43 a 55 mm de comprimento por 130 a 170
μm
de espessura, e machos medem 13 a 23 mm de comprimento por 70 a 80
μm
de espessura. Adultos produzem microfilárias, medindo 177 a 230
μm
de comprimento e 5 to 7
μm
de espessura, que são embainhadas e têm periodicidade noturna. As
microfilárias migram para a linfa e entram na corrente sanguínea
atingindo o sangue periférico .
Os vermes adultos lembram os de
Wuchereria bancrofti mas são
menores. As fêmeas medem 43 a 55 mm de comprimento por 130 a 170
μm
de espessura, e machos medem 13 a 23 mm de comprimento por 70 a 80
μm
de espessura. Adultos produzem microfilárias, medindo 177 a 230
μm
de comprimento e 5 to 7
μm
de espessura, que são embainhadas e têm periodicidade noturna. As
microfilárias migram para a linfa e entram na corrente sanguínea
atingindo o sangue periférico  .
Um mosquito ingere a microfilária durante um repasto sanguíneo .
Um mosquito ingere a microfilária durante um repasto sanguíneo
 .
Após a ingestão, a microfilária perde a bainha e acha seu caminho
através das paredes do proventrículo e porção cardíaca do intestino
médio para atingir os músculos torácicos .
Após a ingestão, a microfilária perde a bainha e acha seu caminho
através das paredes do proventrículo e porção cardíaca do intestino
médio para atingir os músculos torácicos
 .
Aí as microfilárias se desenvolvem em larva de primeiro estágio .
Aí as microfilárias se desenvolvem em larva de primeiro estágio
 e subsequentemente em larvas de terceiro estágio
e subsequentemente em larvas de terceiro estágio
 .
As larvas de terceiro estágio migram através do hemocele para a
probóscide do mosquito .
As larvas de terceiro estágio migram através do hemocele para a
probóscide do mosquito
 e pode infectar outro humano quando o mosquito faz um repasto sanguíneo
e pode infectar outro humano quando o mosquito faz um repasto sanguíneo
 . .
CDC
DPDx
Parasite Image Library
 Figura 20A
Figura 20A
Linfagite escrotal devido a filaríase
CDC
 Figura
20B Figura
20B
Linfonodos inguinais aumentados devido a filaríase.
CDC
 Figura 20C
Figura 20C
Histopatologia
mostrando corte transverso de verme de Dirofilaria no ôlho.
CDC
 Figura
20D
Figura
20D
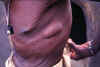
Idoso se despe para banho. Ele tem elefantíase na perna esquerda, grande
hidrocele, pele de leopardo e nódulos de oncocercose, um claramente
visível no seu tronco.
WHO/TDR/Crump
 Figura 20 F
Figura 20 F
Um idoso se senta para banhar-se do lado de fora de sua casa com água de
uma bacia. Ele tem elefantíase na perna esquerda, grande hidrocele, pele
de leopardo na perna esquerda e nódulos de oncocercose.
WHO/TDR/Crump
 Figura 20G
Figura 20G
Um idoso se senta´para banhar-se do lado de for a de sua
casa com água de uma bacia. Ele tem elefantíase na perna esquerda,
grande hidrocele, pele de leopardo na perna esquerda e nódulos de
oncocercose.
WHO/TDR/Crump
 Figura 20H
Figura 20H
Um homem idoso com hidrocele, elefantíase na perna, íngua pendurada,
pele de leopardo e nódulos de oncocercose.
WHO/TDR/Crump
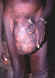 Figura 20I
Figura 20I
Um homem idoso com hidrocele, elefantíase na perna, íngua pendurada e
pele de leopardo. WHO/TDR/Crump
 Figura 20J
Figura 20J
Os pés de um homem idoso mostrando elefantíase e lesões na pele da perna
esquerda e pés.
WHO/TDR/Crump
 Figura 20K
Figura 20K
Esta mulher tem elefentíase na perna direita e edema na esquerda.
WHO/TDR/Crump
 Figura 20L
Figura 20L
Elefantíase da perna devido a filariose.
Luzon, Philippines. CDC
|
|
|
|
|
| |
| |
 Figura 20E
Figura 20E
Um senhor de idade se despe para banho. Ele tem elefantíase na perna
esquerda, grande hidrocele, pele de leopardo e nódulos de oncocercose
claramente visíveis no seu torso.
WHO/TDR/Crump |
| |
|
|
Onchocerca volvulus
(Filariose que cega; cegueira do rio)
Epidemiologia
Oncocercose
é comum nas regiões oriental, central e ocidental, onde é a maior causa de
cegueira. Nas Américas, é encontrada na Guatemala, México, Colombia e
Venezuela. A doença é confinada às vizinhanças de pequenos rios de águas
rasas onde môscas-negras se cruzam. O homem é o único hospedeiro.
Morfologia
Uma fêmea
adulta de oncocerca mede 50 cm por 300 micrômetros, vermes machos são muito
menores. As larvas infectivas de O. volvulus medem 500 micrômetros
por 25 micrômetros (figura 21).
Ciclo de vida
Larvas
infectivas são injetadas na pele humana pela fêmea da môsca-negra (Simulium
damnosum) onde elas se desenvolvem em vermes adultos em 8 a 10 meses. Os
adultos normalmente ocorrem como grupos de vermes bem enrolados (2 a 3
fêmeas e 1 a 2 machos). A fêmea grávida libera larvas microfiláricas, que
são normalmente distribuidas na pele. Elas são coletadas pela môsca-negra
durante um repasto sanguíneo. As larvas migram para a cabeça da môsca e são
então transmitidas para um segundo hospedeiro.
Sintomas
A
oncocercose resulta em lesões nodulares e eritematosas na pele e tecido
subcutâneo devido à resposta inflamatória crônica à infecção persistente
pelo verme. Durante o período de incubação de 10 a 12 meses, ocorre
eosinofilia e urticária. O envolvimento ocular consite na captura da
microfilaria na córnea, coróide, íris e câmara anterior, levando à
fotofobia, lacrimejamento e cegueira (figura 21).
Diagnose
Diagnose é
baseada nos sintomas, história de exposição a môscas-negras e presença de
nódulos de microfilária.
Tratamento e
controle
Ivermectin é
eficiente para matar as larvas, mas não afetam o verme adulto. Medidas
preventivas incluem o controle do vetor, tratamento dos indivíduos
infectados e evitar a môsca-negra.
|
| |
|
Figura
21
|
 Figura 21A
Figura 21A
Microfilaria de
Onchocerca volvulus, de pele de um paciente visto na
Guatemala. Preparação líquida. Algumas características importantes da
microfilária dessas espécies são vistas aqui: ausência de casca; a cauda
é ponteagura no final.
CDC
DPDx Parasite Image Library
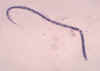 Figura 21B
Figura 21B
Onchocerca volvulus
CDC/Dr. Lee Moore
 Figura 21C
Figura 21C
Onchocerca volvulus, extremidade posterior.
CDC/Dr. Lee Moore
 Figura 21D
Figura 21D
Face de um paciente cego na ala de oncocercose.
WHO/TDR/Crump
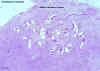 Figura 21E
Figura 21E
Adultos de
Onchocerca volvulus em corte de tumor (H&E)
©
Dr Peter Darben,
Universidade de Tecnologia de Queensland, coleção de parasitologia
clínica. Usado com permissão
 Figura 21F
Figura 21F
Histopatologia de nódulo de Onchocerca volvulus. Oncocercose.
CDC/Dr.
Mae Melvin
 Figura 21G
Figura 21G
Idoso, cego pela oncocercose.
WHO/TDR/Crump
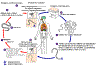 Figura 21H
Figura 21H
Ciclo de vida do
Onchocerca volvulus
Durante um repasto sanguíneo, uma môsca-negra (gênero
Simulium)
introduz larvas filáricas de terceiro estágio na pele do hospedeiro
humano, onde penetram pela lesão da mordida
 .
No tecido subcutâneo as larvas .
No tecido subcutâneo as larvas
 se
desenvolvem em filárias adultas, que comumente residem em nódulos em
tecidos conjuntivos subcutâneos
se
desenvolvem em filárias adultas, que comumente residem em nódulos em
tecidos conjuntivos subcutâneos
 .
Adultos podem viver nos nódulos por aproximadamente 15 anos. Alguns
nódulos podem conter numerosos vermes machos e fêmeas. As fêmeas
medem 33 a 50 cm de comprimento e 270 a 400
μm
de diâmetro, enquanto machos medem 19 a 42 mm por 130 a 210
μm.
Nos nódulos subcutâneos, as fêmeas são capazes de produzir microfilárias
por aproximadmente 9 anos. As microfilárias, medindo 220 a 360 µm por 5
a 9 µm e não cobertas, têm um período de vida que pode chegar a 2 anos.
Elas são ocasionalmente encontradas no sangue periférico, urina, e
escarro mas são tipicamente encontradas na pele e nos vasos linfáticos
dos tecidos conjuntivos .
Adultos podem viver nos nódulos por aproximadamente 15 anos. Alguns
nódulos podem conter numerosos vermes machos e fêmeas. As fêmeas
medem 33 a 50 cm de comprimento e 270 a 400
μm
de diâmetro, enquanto machos medem 19 a 42 mm por 130 a 210
μm.
Nos nódulos subcutâneos, as fêmeas são capazes de produzir microfilárias
por aproximadmente 9 anos. As microfilárias, medindo 220 a 360 µm por 5
a 9 µm e não cobertas, têm um período de vida que pode chegar a 2 anos.
Elas são ocasionalmente encontradas no sangue periférico, urina, e
escarro mas são tipicamente encontradas na pele e nos vasos linfáticos
dos tecidos conjuntivos
 .
Uma môsca-negra ingere as microfilárias durante o repasto sanguíneo .
Uma môsca-negra ingere as microfilárias durante o repasto sanguíneo
 .
Após a ingestão, as microfilárias migram do intestino médio da
môsca-negra pelo hemocele para os músculos torácicos .
Após a ingestão, as microfilárias migram do intestino médio da
môsca-negra pelo hemocele para os músculos torácicos
 .
Aí as microfilárias se desenvolvem em larvas de primeiro estágio .
Aí as microfilárias se desenvolvem em larvas de primeiro estágio
 e subsequentemente em larvas de terceiro estágio infectivas
e subsequentemente em larvas de terceiro estágio infectivas
 .
As larvas de terceito estágio infectivas migram para a probóscide da
môsca-negra .
As larvas de terceito estágio infectivas migram para a probóscide da
môsca-negra  e podem infectar outro humano quando a môsca fizer um repasto sanguíneo
e podem infectar outro humano quando a môsca fizer um repasto sanguíneo
 . .
CDC
DPDx
Parasite Image Library
|
| |
| |
Loa loa
(verme do olho africano)
Loíase é limitada a áreas da floresta equatorial africana. A incidência
em áreas endêmicas variam grandemente (8 a 75 %). Os organismos maiores
de fêmeas medem 60 mm por 500 micrômetros; machos medem 35mm por 300
micrômetros de tamanho (figura 22). As microfilárias circulantes medem
300 micrômetros por 7 micrômetros; as larvas infectivas na môsca medem
200 micrômetros por 30 micrômetros. O ciclo de vida da Loa loa
(figura 23) é idêntico ao da oncocerca, exceto que o vetor para este
verme é a môsca do veado. A infecção resulta em edema subcutâneo
(Calabar) medindo 5 a 10 cm de diâmetro, marcado por eritema e
angioedema,
normalmente nas extremidades. Os organismos migram debaixo da pele e em
uma taxa de uma polegada (2.54 cm) a cada 2 minutos. Consequentemente, o
inchado aparece espontaneamente, persiste por 4 a 7 dias e desaparece, e
é chamado porisso de bolha fugidia ou bolha de Calabar. O verme
normalmente não causa problemas sérios, exceto quando passa pela
conjuuntiva orbital ou pela ponte nasal. O diagnóstico é baseado em
sintomas, história da picada pelo inseto e presença de eosinofilia. A
recuperação dos vermes da conjuntiva é confirmatório. O tratamento e
controle são conseguidos com dietilcarbamazina.
|
| |
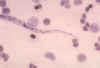 Figura 22A
Figura 22A
Extremidade posterior do Loa loa.
CDC/Dr. Lee Moore
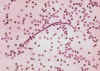 Figura 22B
Figura 22B
Loa loa, agente de filaríase. Extremidade anterior.
CDC/Dr. Lee Moore
 Figura 22C
Figura 22C
Microfilária de Loa loa (direita) e
Mansonella perstans (esquerda). Paciente visto em Camarões. Esfregaço sanguíneo de camada
espêssa corado com hematoxicilina. Loa loa é embainhada, com uma coluna
nuclear relativamente densa; sua cauda estreita e é frequentemente
enrolada, e os núcleos se extendem até o final da cauda. Mansonella
perstans é menor, não tem cobertura, e tem uma cauda de ponta grossa
com núcleos se estentendo até o fim da cauda.
CDC
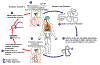 Figura 23
Figura 23
O vetor para a filaríase por
Loa loa são môscas de duas espécies
do gênero Chrysops, C. silacea e C. dimidiata.
Durante o repasto sanguíneo, uma mosca infectada (gênero Chrysops,
môscas que mordem durante o dia) introduzem larvas de terceiro estágio
na pele do hospedeiro humano, onde elas penetram pela lesão da mordida
 .
As larvas se desenvolvem em adultos que normalmente residem em tecidos
subcutâneos .
As larvas se desenvolvem em adultos que normalmente residem em tecidos
subcutâneos
 .
Os vermes-fêmeas medem 40 a 70 mm de comprimento e 0.5 mm de diâmetro,
enquanto que machos medem 30 a 34 mm de comprimento e 0.35 a 0.43 mm de
diâmetro. Agultos produzem microfilárias medindo 250 a 300
μm
por 6 a 8
μm,
que são cobertas e têm periodicidade diurna. Microfilárias têm sido
recuperadas de fluidos espinhais, urina, e escarro. Durante o dia elas
são encontradas no sangue periférico, mas na fase não circulatória, elas
são encontradas nos pulmões .
Os vermes-fêmeas medem 40 a 70 mm de comprimento e 0.5 mm de diâmetro,
enquanto que machos medem 30 a 34 mm de comprimento e 0.35 a 0.43 mm de
diâmetro. Agultos produzem microfilárias medindo 250 a 300
μm
por 6 a 8
μm,
que são cobertas e têm periodicidade diurna. Microfilárias têm sido
recuperadas de fluidos espinhais, urina, e escarro. Durante o dia elas
são encontradas no sangue periférico, mas na fase não circulatória, elas
são encontradas nos pulmões
 .
A mosca ingere microfilárias durante um rapasto sanguíneo .
A mosca ingere microfilárias durante um rapasto sanguíneo
 .
Após a ingestão, as microfilárias perdem suas bainhas e migram do
intestino médio da môsca através do hemocele para os músculos torácicos
do artrópodo .
Após a ingestão, as microfilárias perdem suas bainhas e migram do
intestino médio da môsca através do hemocele para os músculos torácicos
do artrópodo
 .
Aí, as microfilárias se desenvolvem em larvas de primeiro estágio .
Aí, as microfilárias se desenvolvem em larvas de primeiro estágio
 e
subsequentemente em larvas infectivas de terceiro estágio e
subsequentemente em larvas infectivas de terceiro estágio
 .
As larvas infectivas de terceiro estágio migram para a probóscide das
moscas .
As larvas infectivas de terceiro estágio migram para a probóscide das
moscas
 e
podem infectar outro humano quando a mosta fizer um repasto sanguíneo
e
podem infectar outro humano quando a mosta fizer um repasto sanguíneo
 . .
CDC
DPDx
Parasite Image Library
|
| |
| |
|
Sumário |
|
Organismo |
Transmissão |
Sintomas |
Diagnóstico |
Tratamento |
|
Ascaris lumbricoides
|
Oro-fecal |
Dor abdominal, perda de peso, abdomen distendido
|
Fezes: ovo corticóide de forma oval (40-70x35-50
μm) |
Mebendazol |
|
Trichinella spiralis
|
Carne de porco mal cozida |
Depende a localização do verme e da sua carga aflitiva: gastroenterite;
edema, dor muscular, espasmo; eosinofilia, taquicardia, febre, dor de
cabeça e calafrios, vertigem, delírium, coma, etc. |
História clínica, eosinofilia, biópsia muscular, sorologia |
Corticosteróide e Mebendazol
|
|
Trichuris trichiura
|
Oro-fecal |
Dor abdominal, diarréia sanguinolenta, prolapso de reto |
Dor abdominal, diarréia sanguinolenta, prolapso de reto |
Mebendazol |
|
Enterobius vermicularis
|
Oro-fecal |
Prurido perianal, raramente dor abdominal, nausea com vômito |
Fezes: ovos embrionados (60x27
μm),
achatados em um dos lados |
Pamoato de pirantel ou Mebendazol
|
|
Strongyloides
stercoralis
|
Solo-pele, autoinfecção |
Prurido no local da infecção, erupção devido à migração larval,
pneumonia verminosa, dor epigástrica mediana, náusea, vômito, disenteria
sanguinolenta, perda de peso e anemia |
Fezes: larvas rabditiformes (250x 20-25μm) |
Ivermectin ou Tiabendazol
|
|
Necator americanes;
Ancylostoma duodenale
|
Oro-fecal (ovo); penetração pela pele (larvas) |
Eritema maculopapular (coceira inflamatória), broncopneumonia, dor
epigástrica, hemorragia GI, anemia, edema |
Fezes: ovos de forma oval segmentados (60 x 30 20-25μm) |
Mebendazol |
|
Dracunculus medinensis
|
Oral: copépodas na água |
Bolhas na pele, irritação, inflamação |
Exame físico |
Mebendazol
|
|
Wuchereria bancrofti;
W. brugia malayi
(elefantíase)
|
Picada de mosquito |
Febre recorrente, linfadenite, esplenomegalia, linfedema, elefantíase |
História clínica, exame físico, microfilária no sangue (amostra noturna) |
Mebendazol; Dietilcarbamazina |
|
Onchocerca volvulus |
Picada pela mosca-negra |
Lesões nodulares e eritematosas dérmicas, eosinofilia, urticaria,
cegueira |
História clínica, exame físico, microfilária em aspirado nodular |
Mebendazol; Dietilcarbamazina |
|
Loa loa |
Môsca do veado |
Como na oncocercose |
Como na oncocercose |
Dietilcarb-amazina |
|
|
|
 Voltar à Seção de Parasitologia de Microbiologia e Imunologia On-line
Voltar à Seção de Parasitologia de Microbiologia e Imunologia On-line
Esta página foi modificada em
Monday, January 23, 2017
Página mantida por
Richard Hunt
|

 Ovos, não fertilizado (à esquerda) e fertilizado (à direita).
Paciente do Haiti. CDC
DPDx
Parasite Image Library
Ovos, não fertilizado (à esquerda) e fertilizado (à direita).
Paciente do Haiti. CDC
DPDx
Parasite Image Library Ovo contendo uma larva, que será infectiva se ingerida. Paciente de
Léogane, Haiti. CDC
DPDx Parasite Image Library
Ovo contendo uma larva, que será infectiva se ingerida. Paciente de
Léogane, Haiti. CDC
DPDx Parasite Image Library Macho adulto e fêmea de Ancylostoma brasiliense ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland. Usado
com permissão.
Macho adulto e fêmea de Ancylostoma brasiliense ©
Dr Peter Darben,
Universidade de Tecnologia de Queensland. Usado
com permissão.

 Figura 20E
Figura 20E