|
 |
 |
|
Dr Gene Mayer |
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS |
VIROLOGÍA – CAPÍTULO DOCE
INTERACCIONES VIRUS - HUÉSPED
Traducido por :
Sarah M. Castillo - Jorge, Clinica Corominas
Santiago, Rep. Dominicana
|
VIDEOCONFERENCIA
EN INGLÉS |
|
BUSCAR |
|
|
|
|
|
OBJETIVOS
Describir los mecanismos de defense específicos y no específicos del
huésped que se involucran en la resistencia a y recuperación de
infeciones virales.
Discutir el papel del interferon en las infecciones virales
Revisar los mecanismos mediantes los cuales el interferon ejerce su
actividad antiviral
Discutir las contribuciones relativas de los diferentes mecanismos de
defensa del huésped en las infecciones virales |
La
resistencia a y la recuperación de las infecciones virales dependerá de
las interacciones que ocurren entre el virus y el huésped. Las defensas
montadas por el huésped pueden actuar directamente en el virus o
indirectamente en la replicación viral mediante la alteración o
eliminación de la célula infectada. Las defensas no específicas del
huésped funcionan temprano en el encuentro del virus para prevenir o
limitar la infección mientras que las defensas específicas del huésped
trabajan después de la infección en la recuperación de la inmunidad a
estímulos subsiguientes. Aún cuando las defensas del huésped
que se involucran en una infección viral particular dependerán del
virus, dosis y portal de entrada, algunos principios generales de las
interacciones virus – huésped se resumen más adelante.
I.
BARRERAS A LA INFECCIÓN
A.
Barreras inherentes
– El huésped tiene un número de barreras para la infección que son
inherentes al organismo.
Estas
representan la primera línea de defense la cual funciona para prevenir o
limitar una infección.
1.
Piel
La piel actúa como una barrera formidable para la mayoría de los virus y
sólo después de que esta barrera se rompe es que el virus es capaz de
infectar al huésped.
2. Falta de Receptores de Membrana
Los virus adquieren entrada a las células huésped cuando primero se unen
a receptores específicos en ellas (Tabla 1: adaptada de: Roitt,
Immunología, 5ta Ed).
|
PALABRAS CLAVE
Defensas inherentes
Defensas inducidas
Interferón
2'5' Oligo A sintetasa
Proteína cinasa activada por IFN
Actividad antiviral intrínseca
Actividad antiviral extrínseca
ADCC
Immune adherence
NK cells
CTLs |
|
Tabla 1 |
|
Virus |
Receptor |
Tipo celular infectado |
|
VIH |
CD4 |
Células TH |
|
Virus Epstein-Barr |
CR2 (receptor tipo 2 del complement) |
Células B |
|
Influenza A |
Glicoforina A |
Muchos tipos celulares |
|
Rhino virus |
ICAM-1 |
Muchos tipos celulares |
El
rango de huéspedes del virus dependerá de la presencia de estos
receptores. Por tanto, si un huésped carece de los receptores para
un virus o si la célula huésped no posee algunos de los componentes
necesarios para la replicación del virus, el huésped sera
inherentemente resistente a ese virus. Por ejemplo, los ratones
carecen de receptores para los poliovirus y por eso son resistentes
al poliovirus. De igual manera, los humanos son inherentemente
resistentes a virus de plantas y de muchos animales.
3.
Mucus
El mucus que cubre un epitelio actúa como una barrera para prevenir
infecciones de la célula huésped. En algunos casos el mucus
simplemente actúa como una barrera pero en otros casos el mucus
previene una infección al competir con los receptores virales en las
células. Por ejemplo, las familias ortomixo- y paramixovirus
infectan a las células huésped al unirse a receptores de ácido
siálico. En el mucus hay glicoproteínas que contienen ácido siálico
que pueden competir con los receptores celulares y disminuir o
prevenir la unión del virus a las células.
4.
Epitelio ciliado
El epitelio ciliado que involucra al elevador mucociliar puede
ayudar a disminuir la infectividad de ciertos virus. Este sistema ha
demostrado ser importante en las infecciones respiratorias dado que,
cuando la actividad de este sistema está inhibida por fármacos o
infección, hay un aumento de la tasa de infección de un inoculado
viral.
5.
pH bajo
El bajo pH de las secreciones gástricas inactiva la mayoría de los
virus. Sin embargo, los enterovirus son resistentes a las
secreciones gástricas y por tanto pueden sobrevivir y replicarse en
el intestino.
6. Componentes humorales y celulares
Vea más adelante
|
| |
B.
Barreras inducidas
– Cambios que ocurren en el huésped como respuesta a infecciones también
pueden ayudar a disminuir la infectividad viral.
1.
Fiebre
La fiebre puede ayudar a inhibir la replicación viral al potenciar otras
defenses inmunes y al disminuir la replicación viral. La replicación de
algunos virus se reduce con temperaturas de más de 37º C.
2.
Bajo pH
El pH de los infiltrados inflamatorios también es bajo y puede ayudar a
limitar las infecciones virales al inactivar los virus.
3.
Componentes humorales y celulares
Vea más adelante
II.
COMPONENTES HUMORALES INVOLUCRADOS EN LA RESISTENCIA A INFECCIONES
VIRALES
A. No
específicos
– Un número de componentes humorales no específicos del sistema inmune
funcionan en la resistencia a la infección viral. Algunos de estos están
constitutivamente presentes mientras que otros son inducidos por la
infección.
1. Interferón (IFN)
El IFN fue descubierto hace más de 40 años por Issacs y Lindemann
quienes demostraron que fracciones sobrenadantes de células infectadas
por virus contienen una proteína que podría conferir resistencia a la
infección de otras células. Esta sustancia no actuaba directamente en el
virus, sino que actuaba en las células para hacerlas resistentes a la
infección.
(Figura 1).
|
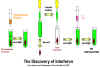 Figura
1
Figura
1
El descubrimiento del interferón
 Figura 2
Figura 2
Respuesta típica a una infección viral aguda |
El
IFN es una de las primeras líneas de defense contra los virus porque
es inducido rápidamente luego de la infección viral, antes de la
aparición de los otros mecanismos de defense (i.e.
anticuerpos, células Tc, etc.) (Figura 2). El lapso de tiempo luego
del cual el IFN se comienza a sintetizar dependerá de la dosis del
virus.
a)
Tipos y Propiedades de Interferones - Tabla 2; Adaptado de: Murray,
Microbiología Médica, 5ta Ed. Tabla 14-3)
|
Tabla 2
Tipos y Propiedades del Interferón |
|
|
Interferon |
|
Propiedad |
Alfa |
Beta |
Gamma |
|
Designaciones previas |
Leucocito IFN
Tipo I |
Fibroblasto IFN
Tipo I |
IFN
Inmune
Tipo II |
|
Genes |
>20 |
1 |
1 |
|
Estabilidad pH2 |
Estable |
Estable |
Lábil |
|
Inductores |
Virus (ARN>ADN)
dcARN |
Virus (ARN>ADN)
dcARN |
Antígenos, Mitógenos |
|
Fuente principal |
Leucocitos, Epitelio |
Fibroblastos |
Linfocitos |
Existen tres tipos de interferón, IFN-alfa (también llamado
leucocito interferón), IFN-beta también llamado fibroblasto
interferón) e IFN-gamma (también llamado interferón inmune). El IFN-alfa
y el IFN-beta también se conocen como Interferón Tipo I y el IFN-gamma
como Tipo II. Hay aproximadamente 20 subtipos de IFN-alfa pero solo
un IFN-beta e IFN-gamma.
Los interferones tienen diferentes características que podría usarse
para distinguirlos (i.e. estabilidad al pH y actividad en
presencia de dodecil sulfato de sodio – SDS, en inglés) pero
actualmente son identificados con el uso de anticuerpos específicos.
b) Inductores de los Interferones – Las células normales no
contienen IFN preformado ni secretan interferon constitutivamente.
Esto es porque los genes del interferón no se transcriben en las
células normales. La transcripción de los genes del IFN ocurre sólo
después de la exposición de las células a un inductor apropiado. Los
inductores de los IFN-alfa e IFN-beta incluyen infección viral, ARN
de doble cadena (i.e. ácido poli inosínico:poli citidílico;
[poli I:C]), lipoproteínas, y componentes de algunas bacterias.
Dentro de estos virus, los virus de ARN son los mejores inductores
mientras que los virus de ADN son pobres inductores de IFN, con la
excepción de los poxvirus. Los infuctores del IFN-gamma incluyen
mitógenos y antígenos (i.e. cosas que activan linfocitos).
|
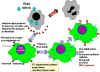 Figura 3
Figura 3
Mecanismo de acción del interferon |
c) Eventos celulares en la Inducción de Interferones – Los
genes del IFN no son expresados en las células normales porque las
células producen una proteína supresora lábil que se une a la región
promotora corriente-arriba del gen e inhibe la transcripción.
Además, la transcripción de los genes requiere de proteínas
activadoras que se unan a la región promotora y enciendan la
transcripción. Los inductores del IFN actúan mediante la prevención
de la síntesis de la proteína supresora o mediante el aumento de los
niveles de proteínas activadoras, encendiendo así en gen IFN. Luego
de que se va el inductor, el gen IFN es apagado por la proteína
supresora y/o la falta de proteínas activadoras. Una vez que el gen
es encendido, se da la transcripción del mismo, el ARNm se
transcribe y la proteína es secretada de la célula. El IFN se unirá
a los receptores de IFN en las células vecinas e inducirá un estado
antiviral en éstas (Figura 3).
|
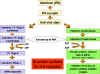 Figura 4
Figura 4
Bases moleculares del estado antiviral |
d)
Eventos celulares en la Acción de los Interferones – La union del IFN a
su receptor resulta en la transcripción de un grupo de genes que
codifican proteínas antivirales involucradas en la prevención de la
replicación viral en esa célula. En consecuencia la célula estará
protegida de infección por virus hasta que las proteínas antivirales
sean degradadas, un proceso que toma varios días. El estado antiviral en
las células tratadas con IFN resulta de la síntesis de dos enzimas que a
su vez, resulta en la inhibición de la síntesis proteica. Una proteína
afecta indirectamente la síntesis proteica al romper el ARNm viral y la
otra afecta directamente la síntesis proteica al inhibir la elongación.
(Figura 4).
Una proteína, llamada 2'5'Oligo A sintetasa, es una enzima que convierte
el ATP en un polímero único (2'5' Oligo A) con enlaces 2'- 5'fofodiester.
Se requiere de ARN de doble cadena para la actividad de esta enzimas. El
2'5'Oligo A en cambio active una ARNasa L que rompe el ARNm viral. La
segunda proteína es una proteína cinasa que, en presencia de ARN de
cadena doble, es aufofosforilada y por tanto activada. La protein cinasa
activada a su vez, fosforila en factor eIF-2 de elongación y lo
inactiva. Mediante la acción de estas dos enzimas IFN-inducidas se
inhibe la síntesis proteica. Aunque la célula infectada puede morir como
consecuencia de la inhibición de la síntesis proteica del huésped, se
deteniene el progreso de la infección. Las células no infectadas no son
eliminadas con el tratamiendo con IFN puesto que la activación de las
dos enzimas require de ARN de doble cadena, que no es sintetizado.
Algunos virus tienen medios para inhibir los efectos antivirales del IFN.
Por ejemplo, los adenovirus producen un ARN que previene la activación
de la proteína cinasa con el dcARN disminuyendo asó los efectos
antivirales del IFN.
|
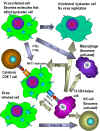 Figura 5
Figura 5
Efectos de los interferones alfa, beta y gamma |
e) Otras Actvidades Biológicas de los Interferones – El IFN no sólo
induce la producción de proteínas antivirales, también tiene otros
efectos en las células, algunos de los cuales indirectamente
contribuyen a la habilidad del huésped a resistir o a recuperarse de
una infección viral (Figura 5). El IFN puede ayudar a modular las
respuestas inmunes por sus efectos en las MHC Clase I y Clase II.
Los IFN-alfa, IFN-beta e IFN-gamma aumentan la expresión de las
moléculas de Clase I en todas las células promoviendo así el
reconocimiento por las células Tc que pueden destruir las células
infectadas por virus. El IFN-gamma también puede aumentar la
expresión de moléculas MHC Clase II en las células presentadoras de
antígenos resultando en una mejor presentación de los antígenos
virales a las células T CD4+. Más aún, el IFN-gamma puede
activar las células NK las cuales pueden eliminar las células
infectadas por virus. Los IFNs también activan las actividades
antivirales intrínsecas y extrínsecas de los macrófagos. La
actividad antiviral intrínseca es la habilidad de los macrófagos
para resistir una infección por un virus y la actividad antiviral
extrínseca es la habilidad de los macrófagos de eliminar otras
células infectadas por virus. Los IFNs también tienen actividad anti-proliferativa
haciéndolos útiiles en el tratamiento de algunas malignidades.
|
| |
f)
Usos Clínicos de los Interferones – Los IFNs han sido usados en el
tratamiento de un númer de enfermedades virales y otras patologías
(Tabla 3; Adaptada de: Mims, Microbiología Médica, Fig 37.5 )
|
Tabla 3
Usos Clínicos de los Interferones |
|
Interferón |
Uso terapéutico |
|
IFN-alfa, IFN-beta |
Hepatitis B
(crónica)
Hepatitis C
Herpes
zóster
Virus
del Papiloma
Rinovirus (solo profiláctico)
Verrugas |
|
IFN-gamma |
Lepra
Lepromatosa
Leshmaniasis
Toxoplasmosis
Enfermedad granulomatosa crónica |
|
| |
Además por sus efectos antiproliferativos los IFNs también han sido
usados en el tratameitno de una variedad de cánceres (Tabla 4;
Adaptado de: Zinsser, Microbiología, 20ava. Ed, Tabla 58.3).
|
Tabla 4
Uso del los Interferones en el Tratamiento del Cáncer |
|
Tumor |
Porcentaje complete o Remisiones Parciales |
|
Leucemia celular vellosa o pilosa |
90 |
|
Leucemia mielocítica crónica |
90 |
|
Linfoma de células T |
53 |
|
Sarcoma de Kaposi |
42 |
|
Neoplasmas endócrinos pancreáticos |
30 |
|
Linfomas No-Hodgkin |
25 - 35 |
|
| |
No
obstante, los efectos colaterales de la terapia con IFN limitan su
uso casual en la medicina clínica (Tabla 5; Adaptado de: Mims,
Microbiología Médica, Fig. 37.6).
|
Tabla 5
Efectos Adversos Comunes de los Interferones |
|
Interferones |
Fiebre
Malestar general
Fatiga
Mialgias
Toxicidad a:
riñones
hígado
médula ósea
corazón |
|
| |
2.
Complemento
La mayoría de los virus no fijan el complemento por su ruta alternative.
Sin
embargo, la interacción del anticuerpo fijador de comlemento con una
célula infectada por virus o con un virus envuelto puede resultar en la
lisis de la célula o del virus. Por tanto, al interactuar con el sistema
inmune específico, el complemento también juega un rol en la resistencia
a infecciones.
3. Citocinas
Otras citocinas aparte del IFN también juegan un papel importante en la
resistencia a las infecciones virales.
El factor de necrosis tumoral alfa (TNF-α), interleucina-1 (IL-1) e IL-6
han demostrado tener actividad antiviral in vitro.
Estas citocinas se producen por macrofagos activados pero su
contribucion in vivo a la resistencia no ha sido completamente
elucidada.
|
| |
B.
Específico
–
Los anticuerpos producidos por el sistema immune específico se
involucran primordialmente en la recuperación de la infección vírica
y en la resistencia a estímulos subsiguientes del virus.
Los anticuerpos IgG, IgM e IgA pueden todos jugar un papel en la
inmunidad a una infección viral pero las contribuciones relatives de
las diferentes clases dependen del virus y la puerta de entrada. Por
ejemplo, la IgA será más importante cuando son virus que infectan la
mucosa mientras que los anticuerpos IgG lo son en las infecciones en
las que la viremia es la característica prominente. Los anticuerpos
pueden tener efectos tanto beneficiosos como dañinos para el
huésped.
1.
Efectos beneficiosos
(Tabla 6; Adaptada de: Roitt, Immunología 5ta Ed., Fig
16.5) – Los anticuerpos pueden neutralizar directamente un virus al
prevenir la fijación del virus a receptores en las células huésped o
la entrada del virus a las mismas. Los anticuerpos también pueden
prevenir la pérdida de la envoltura viral al interferir con las
proteínas involucradas en este proceso. Los anticuerpos de fijación
de complemento pueden asistir en la lisis de células infectadas por
virus o de virus envueltos. Los anticuerpos también pueden actuar
como opsoninas y aumentar la fagocitosis de los virus sea
promoviendo su integración vía Fc o receptores C3b o mediante la
aglutinación de virus para hacerlos más susceptibles de fagocitosis.
Las células infectadas por virus y cubiertas con anticuerpos pueden
ser eliminadas por células K previniendo así la diseminación de la
infección.
|
Tabla 6
Efectos Antivirales de los Anticuerpos |
|
Diana |
Agente |
Mecanismo |
|
Virus libre |
Anticuerpo solo |
Bloquea la fijación a la célula
Bloquea la entrada a la célula
Bloquea la pérdida de la envoltura viral |
|
Anticuerpo + Complemento |
Daño a
la envoltura viral
Opsonización del virus |
|
Célula infectada por virus |
Anticuerpo + Complemento |
Lisis
de la célula infectada
Opsonización de la célula infectada |
|
Anticuerpo unido a célula infectada |
Citotoxicidad Celular Dependiente de Anticuerpo (ADCC, siglas en inglés)
por las células K, células NK y/o macrófagos |
2.
Efectos dañinos
a)
Daño inmunopatológico – La fijación de complemento por complejos inmunes
puede resultar en la liberación de aminas vasoactivas, el recrutamiento
de células inflamatorias y el subsiguiente daño al tejido celular.
Algunos virus como el virus de la coriomeningitis linfocítica producen
grandes cantidades de complejos imunes en la circulación que se alojan
en los lechos vasculares y en los riñones en donde fijan complemento y
provocan daño tisular. Otros ejemplos de virus que causan estos efectos
son: paperas, virus sincitial respiratorio, virus del dengue y virus de
la hepatitis sérica.
b)
Adherencia inmune – La opsonización de los virus con anticuerpo puede
mejorar su integración a las células fagocíticas. Si el virus es capaz
de sobrevivir en el fagocito, esto permite la diseminación de la
infección viral. El dengue y el VIH son ejemplos de virus que pueden
sobrevivir en macrófagos.
3.
Serología
Dado que el aislamiento y la identificación de los virus no es un
procedimiento de rutina en los laboratorios clínicos, el cuadro clínico
y la serología juegan un papel mayor en el diagnóstico de enfermedades
virales. Los mayores tipos de anticuerpos que son analizados son
anticuerpos neutralizantes, de inhibición de hemaglutinación y de
fijación de complemento. Los anticuerpos de fijación de complemento
siguen la cinética de la IgM y son muy útiles en la indicación de
infección reciente o actual. En contraste, los anticuerpos de
neutralización de hemaglutinación siguen la cinética de la IgG,
persisten por mucho tiempo y son analizados para evaluar la inmunidad.
El desarrollo de ancuerpos para diferentes componentes del virus se ha
utilizado para estadiaje de la enfermedad. Por ejemplo, en las
infecciones de hepatitis B y VIH se usa este abordaje.
|
| |
III.
COMPONENTES CELULARES
Además de
las barreras y de los componentes humorales involucrados en la resistencia y
recuperación de infecciones virales, existen diferentes células que juegan
un papel en nuestras defenses antivirales.
A. No
específicos
1.
Macrófagos
Debido a su localización en diversas partes en el cuerpo, los macrófagos son
una de las células que primero encuentran a los virus. Hay evidencia
experimental sugestiva de que estas células juegan un papel importante en la
resistencia de infecciones virales. Por ejemplo, los ratones neonatos son
susceptibles de infecciones por el virus herpes tipo 1 gracias a un defecto
en la capacidad de los macrófagos de prevenir la replicación del virus. Los
macrófagos de ratones adultos sin embargo, son capaces de prevenir la
replicacin del virus y estos ratones son resistentes a la infección por este
virus. De igual manera, en animales que han sido depletados de macrófagos
hay mayor susceptibilidad a infecciones por una diversidad de virus.
Los
macrófagos contribuyen a las defensas antivirales en variadas maneras.
a)
Actividad antiviral intrínseca – Los macrófagos pueden ser infectados con
virus pero muchos virus son incapcez de replicarse en los macrófagos. Los
macrófagos que son activados (i.e. por IFN-γ)
son todavía más capaces de resistir la replicación viral. Por tanto, los
macrófagos ayudan a limitar las infecciones víricas debido a su habilidad
intrínseca para prevenir la replicación viral. No obstante, algunos virus sí
son capaces de replicarse o por lo menos de sobrevivir en los macrófagos y
por tanto pueden ser diseminados por los mismos (vea arriba).
b)
Actividad antiviral extrínseca – Los macrófagos también son capces de
reconocer las células infectadas por virus y de eliminarlas. Por tanto,
contribuyen también a las defensas antivirales mediante su actividad
citotóxica.
c)
Citotoxicidad Celular Dependiente de Anticuerpos (ADCC, por sus siglas en
inglés) – Las células infectadas por virus que son cubiertas con
anticuerpos IgG pueden ser eliminadas por los macrófagos por su actividad
citotóxica dependiente de anticuerpos.
d)
Producción de IFN – Los macrófagos son una fuente de IFN.
2. Células NK
Hay evidencia experimental que también sugiere que las células NK también
tienen un rol en la resistencia a las infecciones virales. Los ratones que
son repletados de células NK son más osusceptibles a las infecciones de
ciertps virus. Así mismo, los pacientes con una baja actividad de células NK
son más susceptibles a recurrencias del virus herpes simples tipo 1. Las
células NK actúan mediante el reconocimiento y eliminación de células
infectadas por virus. El reconocimiento no es restringido a MHC ni es
antígeno específico. Por tanto, las células NK eliminan células infectadas
por muchos tipos de virus diferentes. Las células NK también pueden mediar
una citotoxicidad celular dependiente de anticuerpos y pueden, con este
mecanismo, eliminar células infectadas. Las actividades de las células NK
son estimuladas por el IFN-γ
e Il-2 (vea arriba).
|
| |
B. Específicos
1. Células T
– Las células T juegan un papel en la recuperación de las infecciones virales.
Las células T citotóxicas generadas en respuesta a los antígenos virales en las
células infectadas pueden eliminar las células infectadas previniendo así la
diseminación de la infección. Las células T colaboradoras (Th) se involucran en
la generacón de células T citotóxicas y ayudan a las células B a sintetizar
anticuerpos. Además, las linfoquinas secretadas por las células T pueden
reclutar y activar los macrófagos y células NK ayudando a mobilizar un ataque
concertado al virus.
|
| |
IV. RESUMEN
DE LAS DEFENSAS
Tabla 7
(Adaptada de: Baron, Microbiología Médica, 2a Ed., Tabla 69-2)
resumen de las defenses del huésped contra las infecciones virales e
indicación de el objetivo de cada una de estas defensas.
|
Tabla 7
Funciones Efectoras del huésped en las Infeccines Virales |
|
Defensa del huésped |
Efector |
Diana del efector |
|
Respuestas tempranas no específicas |
Fiebre
Fagocitosis
Inflamación
Actvidad de células NK
Interferón |
Replicación viral
Virus
Replicación viral
Célula
infectada por virus
Replicación viral, inmunomodulación |
|
Respuestas inmunes mediadas por células |
Linfocitos T citotóxicos
Macrófagos activados
Linfocinas
Citotoxicidad celular dependiente de anticuerpos (ADCC, por sus siglas
en inglés) |
Célula infectada por virus
Virus, célula infectada por virus
Célula
infectada por virus, inmunomodulación
Célula infectada por virus |
|
Respuestas inmunes humorales |
Anticuerpo
Anticuerpo + complemento |
Virus, célula infectada por virus
Virus, célula infectada por virus |
V.
CONTRIBUCIONES RELATIVAS DE LOS MECANISMOS DE DEFENSA DEL HUÉSPED
La
contribución relativa de los diversos mecanismos de defense del huésped va a
depender de la naturaleza del virus y de su portal de entrada. Los
anticuerpos serán más importantes en las infecciones en las que la viremia
sea una característica prominente. No obstante, los anticuerpos quizás no
sean útiles en las infecciones por herpes o paramixovirus en las que el
virus puede transferirse de célula a célula mediante fusion. En esta
instancia la inmunidad mediada por células es más importante. Si un virus
solo infecta células en las superficies mucosas, los anticuerpos IgA pueden
ser importantes.
El
entendimiento de los mecanismos de defense del huésped es importante para el
desarrollo de vacunas y la correcta administración de las mismas. Si los
anticuerpos IgA son importantes para la protección contra un virus en
particular, entonces cualquier vacuna ha de ser capaz de estimular la
producción de anticuerpos IgA en las superficies mucosas apropiadas.
Alternativamente, si los linfocitos T citotóxicos son importantes, entonces
la vacuna ha de ser capaz de estimular su producción. Es por ello que con
frecuencia las vacunas de virus vivos atenuados son preferibles a las
vacunas de virus muertos dado que las vacunas de virus atenuados
generalmente conllevan a generación de linfocitos T citotóxicos mientras que
las vacunas de vivos muertos no.
|
| |
VI.
INMUNOPATOLOGÍA INDUCIDA POR VIRUS
Aunque el huésped tiene una gran variedad de defenses para
protegerse de las infecciones virales, algunas veces la respuesta
immune a la infección es la causa directa de injuria tisular. Por
ejemplo, los niños infectados con citomegalovirus tienen complejos
inmunes circulantes que son depositados en los riñones y en las
articulaciones resultando en patologías tales como arthritis y
nefritis glomerular. Otro ejemplo es el síndrome del choque de
hemorragia fatal que ocurre con las infecciones del virus del
dengue. En esta instancia la fijación del complemento por los
complejos inmunes circulantes resulta en la liberación de productos
de la cascada de complemento conllevando a un súbito incremento de
la permeabilidad vascular, choque y muerte.
VII. INMUNOSUPRESIÓN
Muchos virus son capaces de suprimir las respuestas inmunes y, por
tanto, de vencer o minimizar las defenses del huésped. El mejor
ejemplo es el VIH, el cual infecta las células CD4+
destruyendo así el sistema inmune específico. Otros virus (i.e..el
virus de la sarampión) pueden tambien infectar linfocitos y afectar
su replicación y diferenciación. La inmunosupresión inducida por
virus es un problema grande en el desarrollo de vacunas. Algunos de
los mecanismos mediante los cuales los virus pueden evader las
defenses del huésped se ilustran en la Tabla 8 (Adaptada de: Roitt,
Inmunología 5ta Ed., Fig 16.10).
|
Tabla 8
Productos Virales que Interfieren con las Defensas del Huésped |
|
Defensas del huésped afectadas |
Virus |
Producto Vírico |
Mecanismo |
|
Interferón |
VEB |
EBERS (pequeños ARNs) |
Bloquea la activación de la proteína cinasa |
|
Vaccinia |
eIF-2alfa homólogo |
Previene la fosforilación del eIF-2alfa por la proteína cinasa |
|
Complemento |
Vaccinia |
Homólogos de las proteínas de control del complemento |
Bloquea la activación del complemento |
|
Anticuerpo |
VHS-1 |
gE/gI |
Se una a la Fc-gamma y bloquea su función |
|
Citocinas |
Mixoma |
Homólogo del receptor del IFN-gamma |
Compite por IFN-gamma y bloquea su función |
|
Virus del fibroma de Shope |
Receptor del Factor de Necrosis Tumoral |
Compite por el Factor de Necrosis Tumoral y bloquea su función |
|
VEB |
Homólogo de la IL-10 |
Reduce la función del IFN-gamma |
|
CMH Clase I |
CMV |
Proteína de fase temprana |
Previene el transporte del CMH cargado de péptido |
|
Adenovirus |
E3 |
Bloquea el transporte del CMH a la superficie |
|
Apoptosis |
Adenovirus |
14.7K |
Inhibe las capsases |
|
VEB |
Homólogo del Bcl-2 |
Anti-apoptótico |
|
Células NK |
HCMV |
UL-18 |
El homólogo del CMH inhibe las células NK |
|
|
|
 Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Derechos de autor 2008 The Board of Trustees of the University of South Carolina
Esta página se modificó
recientemente en
Monday, January 28, 2008
Mantenimiento de la pagina por
Richard Hunt
Favor de reportar problemas a
rhunt@med.sc.edu
|

 Figura
1
Figura
1 Figura 3
Figura 3 Figura 4
Figura 4 Figura 5
Figura 5 