|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
PARASITOLOGIA
CAPÍTULO
UM
PROTOZOÁRIOS INTESTINAIS E LUMINAIS
Dr
Abdul Ghaffar
Emeritus Professor
University of South Carolina School of Medicine
Tradução: PhD. Myres Hopkins
|
|
|
|
EM INGLÊS
|
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
|
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|
|
|
 |
|
Aprenda Plugado
|
|
OBJETIVOS
Epidemiologia, morbidez e mortalidade
Morfologia do organism
Ciclo de vida, hospedeiros e vetores
Doença, sintomas, patogênia e local
Diagnóstico Prevenção e controle
|
Um parasita é um
organismo que obtém alimento e proteção de outro organismo e tira proveito desta
associação. O parasita é denominado obrigatório quando ele só pode viver em um
hospedeiro; é classificado como facultativo quando pode viver tanto em
hospedeiro como na forma livre. Parasitas que vivem dentro do corpo são
denominados endoparasitas, enquanto aqueles que existem na superfície do corpo
são chamados ectoparasitas. Parasitas que causam danos ao hospedeiro são
parasitas patogênicos enquanto aqueles que se beneficiam do hospedeiro sem
causar danos são conhecidos como comensais.
O organismo que
abriga o parasita e sofre prejuízo provocado pelo parasita é um hospedeiro. O
hospedeiro no qual o parasita vive seu estágio adulto e sexual é o hospedeiro
definitivo, enquanto que o hospedeiro no qual o parasita vive como estágio
larval e asexual é o hospedeiro intermediário. Outros hospedeiros que abrigam
parasitas e portanto garantem a continuidade do ciclo de vida do parasita e age
como fonte adicional de infecção humana são conhecidos como hospedeiros
reservatórios. Um organismo (normalmente um inseto) que é responsavel pela
transmissão de infecção parasitária é conhecido como vetor.
PROTOZOÁRIOS INTESTINAIS E UROGENITAIS
Protozoários
intestinais e luminais significantes para a saúde humana incluem
·
Entamoeba histolytica
(Ameba)
·
Balantidium coli
(Ciliados)
·
Giardia lamblia e Trichomonas vaginalis (Flagelados)
·
Cryptosporidium parvum
e Isospora belli (Sporozoa)
AMEBIASE (disenteria
amebiana, hepatite amebiana)
Etiologia
E. histolytica é a principal causa de disenteria amebiana.
Epidemiologia
0.5 a 50% da população mundial tem E. histolytica com maiores taxas
de infecção ocorrendo em países subdesenvolvidos. 1 to 3% da população dos
Estados Unidos é infectada. A infecção está associada à pobre higiene.
Humanos são os principais hospedeiros, embora cães, gatos e roedores possam
estar infectados.
Morfologia
Trofozoíto:
Esta forma tem uma aparência amebóide e tem normalmente 15-30 micrometros de
diâmetro, embora linhagens mais invasivas tendam a ser maiores. O organismo
tem um núcleo único com um cariossomo pequeno distinto (Figura 1A,B). O
retículo endoplasmático granuloso fino contém eritrócitos ingeridos (Figura
1C). A cromatina nuclear é uniformemente distribuida na periferia do núcleo.
Cisto:
Os cistos de Entameba histolytica são esféricos, com uma parêde
refrátil; o citoplasma contém corpos cromatóides escuros e 1 a 4 núcleos com
um cariossomo central e cromatina periférica uniformemente distribuída (Figura
2).
Ciclo de
vida
A infecção
ocorre pela ingestão dos cistos presentes em alimentos ou em mãos
contaminadas com fezes. O cisto é resistente ao ambiente gástrico e passa
para o intestino delgado onde é desencistado. O metacisto se divide em
quatro e depois em oito amebas que se movem para o intestino grosso. A
maioria dos organismos sai do corpo pelas fezes mas, em infecções macissas,
algumas amebas aderem e invadem o tecido mucoso formando lesões ulcerativas
tipo “fundo de garrafa, cantil ou botão de camisa”. Os organismos encistam
para mitose e são eliminados nas fezes (Figura 3). Não há hospedeiros
intermediários ou reservatórios.
|
|
Figura 1
|
A
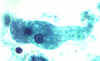 B
B
A, B: Trofozoítos de
Entamoeba histolytica. Corante tricrômico.
Os trofozoítos são alongados (até 60 µm de comprimento), como tendem a
aparecer nas fezes diarréicas. (Em fezes não diarréicas eles são
arredondados e medem 15-20 µm.) O núcleo mostra um cariossomo situado
centralmente com uma cromatina periférica uniformemente distribuída.
CDC
DPDx Biblioteca de
Imagens de ParasitasC
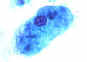
 Trofozoítos de
Entamoeba histolytica. Corante tricrômico.Duas
característcas diagnósticas são vistas aqui: dois dos trofozoítos têm
eritrócitos ingeridos e o núcleo tem tipicamente um cariossomo pequeno e
localizado centralmente, assim como uma cromatina periférica fina e
homogênea.
Trofozoítos de
Entamoeba histolytica. Corante tricrômico.Duas
característcas diagnósticas são vistas aqui: dois dos trofozoítos têm
eritrócitos ingeridos e o núcleo tem tipicamente um cariossomo pequeno e
localizado centralmente, assim como uma cromatina periférica fina e
homogênea.
CDC
DPDx Biblioteca de
Imagens de Parasitas
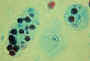
 Cisto e trofozoíto de
Entamoeba histolytica, corado por
hematoxilina
Cisto e trofozoíto de
Entamoeba histolytica, corado por
hematoxilina
©
Dr Peter Darben,
Coleção de parasitologia clínica da Universidade de Tecnologia de
Queensland. Usado com permissão.
 Trofozoítos de
Entamoeba histolytica em secção do intestino
(H&E)
Trofozoítos de
Entamoeba histolytica em secção do intestino
(H&E)
©
Dr Peter Darben,
Queensland Coleção de parasitologia clínica da Universidade de
Tecnologia de Queensland. Usado com permissão.
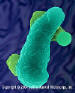 Ameba (Entamoeba histolytica) provoca disenteria amebiana e úlceras (estágio
vegetativo trofozoítico). A disenteria amebiana é espalhada pela
contaminação fecal de alimentos e água e é mais comum em condições
sanitárias precárias.
Ameba (Entamoeba histolytica) provoca disenteria amebiana e úlceras (estágio
vegetativo trofozoítico). A disenteria amebiana é espalhada pela
contaminação fecal de alimentos e água e é mais comum em condições
sanitárias precárias.
©
Dennis Kunkel Microscopy, Inc.
Usado com permissão
|
|
Figura 2 |
A
 B
B
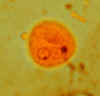 Cistos de
Entamoeba histolytica, corados com tricromo (A) e iodo
(B). Cada cisto tem 4 núcleos, dos quais 3 (em A) e 2 (em B) são
visíveis no plano focal (o quarto núcleo está próximo do foco em D). O
núcleo tem cariossomos caracteristicamente localizados centralmente. O
cistos em A contém um grande corpo cromatóide. O cisto de Entamoeba
histolytica mede 12-15 µm
Cistos de
Entamoeba histolytica, corados com tricromo (A) e iodo
(B). Cada cisto tem 4 núcleos, dos quais 3 (em A) e 2 (em B) são
visíveis no plano focal (o quarto núcleo está próximo do foco em D). O
núcleo tem cariossomos caracteristicamente localizados centralmente. O
cistos em A contém um grande corpo cromatóide. O cisto de Entamoeba
histolytica mede 12-15 µm
CDC
DPDx Biblioteca de
Imagens de Parasitas
|
|
Figura 3 |
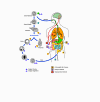 Ciclo de vida da
Entamoeba histolytica
Ciclo de vida da
Entamoeba histolytica
A infecção pela Entamoeba histolytica
ocorre pela ingestão de
cistos maduros (1) em alimentos, água ou mãos contaminadas com fezes. O
encistamento (2) ocorre no intestino delgado e trofozoítos (3) são
liberados, que migram para o intestino grosso. Os trofozoítos se
multiplicam por fissão binária e produzem cistos (4), que são eliminados
nas fezes. Devido à proteção conferida por suas paredes, os cistos podem
sobreviver dias a semanas no ambiente externo e são responsáveis pela
transmissão. (Os trofozoítos podem tambémd ser eliminados em fezes
diarréicas, mas são rapidamente destruidos fora do corpo, e se ingeridos
não sobrevivem à exposição ao ambiente gástrico). Em muitos casos, os
trofozoítos permanecem confinados no lúmen intestinal (A: infecção
não-invasiva) de indivíduos que são portanto portadores assintomáticos e
eliminadores de cistos. Em alguns pacientes os trofozoítos invadem a
mucosa intestinal (B: doença intestinal), ou, através da corrente
sanguínea, sítios extraintestinais tais como o fígado, cérebro, e
pulmões (C: doença extra-intestinal), com manifestações patológicas
resultantes. Estabeleceu-se que as formas invasivas e não invasivas
representam espécies separadas, respectivamente E. histolytica e
E. dispar, que são morfologicamente indistinguíveis. A
transmissão pode também ocorrer através da exposição fecal durante o
contato sexual (caso em que não somente cistos, mas também trofozoídos
podem ser infectivos). CDC
DPDx Biblioteca de
Imagens de Parasitas
|
| |
Sintomas
Agudos:
Disenteria frequente com mucosa necrótica e dor abdominal.
Crônicos:
Episódios recorrentes de disenteria com sangue e muco nas fezes. Ocorrem
distúrbios gastrointestinais intervenientes e constipação. São
encontrados cistos nas fezes. O organismo pode invador o fígado, pulmões
e cérebro onde produzem abcessos que resultam em disfunção hepática,
pneumonia e encefalite.
Patologia
Úlceras intestinais (Figura 4) devido a degradação enzimática do tecido. A
infecção pode levar à apendicite, perfuração, estreitamento por granuloma ,
pseudo pólipos, abcesso hepático (Figura 4); às vezes podem ocorrer abcessos
cerebrais, pulmonares e esplênicos
Estreitamento
e pseudo-pólipos resultam da resposta inflamatória do hospedeiro.
Imunologia
Há uma resposta humoral após infecção invasiva (abcesso hepático ou colite)
mas isto é de significância questionável na imunidade, visto que há
recorrência de episódios entéricos nesses pacientes.
Diagnóstico
Sintomas, histórico e epidemiologia são as chaves do diagnóstico. No
laboratório, a infecção é confirmada pelo encontro de cistos nas fezes (Figura
1). Infecção por E. histolytica é dinguida da disenteria bacilar pela
ausência de febre alta e ausência de leucocitose por PMN.
Precisa ser
feita distinção de outro protozoário intestinal (ex., Entamoeba
coli, Entamoeba hartmanni, Dientamoeba fragilis, Endolimax nana, Iodamoeba
buetschlii, etc.). (Figura 5)
Tratamento
Iodoquinol
é usado para
tratar infecções assintomáticas e metronidazol é usado para amebíase
sintomática e crônica, incluindo doença extra-intestinal.
|
|
Figura 4
|
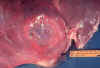 Patologia bruta do fígado contendo abcesso amebiano
Patologia bruta do fígado contendo abcesso amebiano
CDC/Dr. Mae Melvin; Dr. E. West of Mobile, AL
DPDx Biblioteca de
Imagens de Parasitas
 Patologia bruta de abcesso amebiano do fígado. Tubo de pus “chocolate”
do abcesso.
Patologia bruta de abcesso amebiano do fígado. Tubo de pus “chocolate”
do abcesso.
CDC/Dr. Mae Melvin; Dr. E. West of Mobile, AL
 Histopatologia de uma úlcera típica de amebíase intestinal, conhecida
como “Fundo de garrafa, Cantil ou Botão de camisa”. CDC/Dr. Mae Melvin
Histopatologia de uma úlcera típica de amebíase intestinal, conhecida
como “Fundo de garrafa, Cantil ou Botão de camisa”. CDC/Dr. Mae Melvin
|
|
Figura
5
|
 Entamoeba coli:
Trofozoíto corado em tricromo mostrando um cariossomo grande excêntrico
e um citoplasma grosseiro e vacuolizado. Os trofozoítos de E. coli medem
normalmente 20-25 µm, mas eles podem estar elongados (como é o caso aqui)
e atingirem 50 µm.
Entamoeba coli:
Trofozoíto corado em tricromo mostrando um cariossomo grande excêntrico
e um citoplasma grosseiro e vacuolizado. Os trofozoítos de E. coli medem
normalmente 20-25 µm, mas eles podem estar elongados (como é o caso aqui)
e atingirem 50 µm.
DPDx Biblioteca de
Imagens de Parasitas
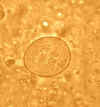 Cistos de
Entamoeba coli, montagem líquida em iôdo. Cistos
maduros tipicamente têm 8 núcleos, e medem normalmente 15 a 25 µm (a
variação é 10 a 35 µm). O cisto na Figura mostra 5 núcleos visíveis
neste plano focal.
Cistos de
Entamoeba coli, montagem líquida em iôdo. Cistos
maduros tipicamente têm 8 núcleos, e medem normalmente 15 a 25 µm (a
variação é 10 a 35 µm). O cisto na Figura mostra 5 núcleos visíveis
neste plano focal.
DPDx Biblioteca de
Imagens de Parasitas
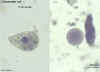 Cistos de
Entamoeba coli e trofozoíto, corado com hematoxilina
Cistos de
Entamoeba coli e trofozoíto, corado com hematoxilina
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão
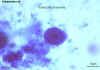 Entamoeba coli trophozoite, trichrome stained
Entamoeba coli trophozoite, trichrome stained
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão
|
|
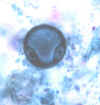 Entamoeba coli: Trofozoíto, corado em tricromo, mostrando uma cariossomo
caracteristicamente grande e excêntrico, e um citoplasma grosseiro e
vacuolizado. Os trofozoítos de E. coli medem normalmente 20-25 µm, mas
eles podem estar elongados (como é o caso aqui) e atingirem 50 µm. CDC
DPDx Biblioteca de
Imagens de Parasitas
Entamoeba coli: Trofozoíto, corado em tricromo, mostrando uma cariossomo
caracteristicamente grande e excêntrico, e um citoplasma grosseiro e
vacuolizado. Os trofozoítos de E. coli medem normalmente 20-25 µm, mas
eles podem estar elongados (como é o caso aqui) e atingirem 50 µm. CDC
DPDx Biblioteca de
Imagens de Parasitas
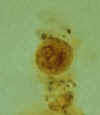 Entamoeba hartmanni: Cisto, com um núcleo visível neste plano focal;
muito semelhante aos cistos de E. histolytica, porém diferenciados pelo
seu tamanho menor (5-10 µm comparado a 10-20 µm)
Entamoeba hartmanni: Cisto, com um núcleo visível neste plano focal;
muito semelhante aos cistos de E. histolytica, porém diferenciados pelo
seu tamanho menor (5-10 µm comparado a 10-20 µm)
CDC
DPDx
Biblioteca de
Imagens de Parasitas
A
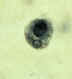 B
B 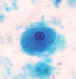 Entamoeba hartmanni: A, B: Trofozoítos corados com tricromo: os
trofozoítos e E. hartmanni são semelhantes aos de E. histolytica, com um
pequeno e centralmente localizado cariossomo, cromatina periferal fina e
citoplasma granular fino; a principal deferença é seu tamanho menor:
5-12 µm comparado com 10-60 µm da E. histolytica. Note que em (A) o
trofozoíto ingeriu um fungo e não um eritrócito. (Ingestão de
eritrócitos é patognomônica de E. histolytica.) CDC
DPDx Biblioteca de
Imagens de Parasitas
Entamoeba hartmanni: A, B: Trofozoítos corados com tricromo: os
trofozoítos e E. hartmanni são semelhantes aos de E. histolytica, com um
pequeno e centralmente localizado cariossomo, cromatina periferal fina e
citoplasma granular fino; a principal deferença é seu tamanho menor:
5-12 µm comparado com 10-60 µm da E. histolytica. Note que em (A) o
trofozoíto ingeriu um fungo e não um eritrócito. (Ingestão de
eritrócitos é patognomônica de E. histolytica.) CDC
DPDx Biblioteca de
Imagens de Parasitas A
 B B
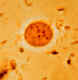 C
C
 Endolimax nana: Trofozoíto corado em tricromo (A) e cistos corados em
iôdo (B) e em trocromo (C). Note no trofozoíto o cariossomo
caracteristicamente grande e a ausência de cromatina periferica. Os
cistos são maduros, eles contém quatro núcleos que são muito menores do
que o núcleo dos trofozoítos e não têm cromatina periférica. Os
trofozoítos medem normalmente 8-10 µm, enquanto que os cistos medem
normalmente 6-8 µm.
Endolimax nana: Trofozoíto corado em tricromo (A) e cistos corados em
iôdo (B) e em trocromo (C). Note no trofozoíto o cariossomo
caracteristicamente grande e a ausência de cromatina periferica. Os
cistos são maduros, eles contém quatro núcleos que são muito menores do
que o núcleo dos trofozoítos e não têm cromatina periférica. Os
trofozoítos medem normalmente 8-10 µm, enquanto que os cistos medem
normalmente 6-8 µm.
CDC
DPDx Biblioteca de
Imagens de ParasitasA
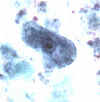 B
B
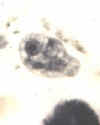 C
C
 Iodamoeba bütschlii: Trofozoítos corados com tricromo (A) e com
hematoxilina-eosina (B), e cisto corado em tricromo (C). Note os
cariossomos grandes nos trofozoítos, e em (B) o cariossomo rodeado por
grânulos acromáticos refráteis. No cisto (C), uma grande massa de
glicogênio empurra o núcleo para o lado. Os trofozoítos medem
normalmente 12-15 µm e os cistos medem normalmente 10-12 µm.
Iodamoeba bütschlii: Trofozoítos corados com tricromo (A) e com
hematoxilina-eosina (B), e cisto corado em tricromo (C). Note os
cariossomos grandes nos trofozoítos, e em (B) o cariossomo rodeado por
grânulos acromáticos refráteis. No cisto (C), uma grande massa de
glicogênio empurra o núcleo para o lado. Os trofozoítos medem
normalmente 12-15 µm e os cistos medem normalmente 10-12 µm.
CDC
DPDx Biblioteca de
Imagens de Parasitas
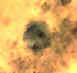
 Trofozoítos de Dientamoeba fragilis corados com tricromo. Dientamoeba
fragilis não é uma ameba, e sim um flagelado! Deve ser portanto
morfologicamente diferenciado de amebas. O núcleo é um aglomerado de
grânulos, sem cromatina periférica. O tamanho varia de 5-15 µm. Esta
espécie não tem estágio de cisto. Contribuição de imagem de Georgia
Departmamento de Saúde Pública/CDC
DPDx
Biblioteca de
Imagens de Parasitas
Trofozoítos de Dientamoeba fragilis corados com tricromo. Dientamoeba
fragilis não é uma ameba, e sim um flagelado! Deve ser portanto
morfologicamente diferenciado de amebas. O núcleo é um aglomerado de
grânulos, sem cromatina periférica. O tamanho varia de 5-15 µm. Esta
espécie não tem estágio de cisto. Contribuição de imagem de Georgia
Departmamento de Saúde Pública/CDC
DPDx
Biblioteca de
Imagens de Parasitas
|
| |
GIARDIASE (lamblíase)
Etiologia
Giardia lamblia
(um flagelado)
Epidemiologia
Giardia tem distribuição mundial e não é incomum na Carolina
do Sul. É a doença intestinal por protozoário mais frequente nos
EUA e a causa de doenças associadas ao comprometimento de sistemas
de purificação de águas, bebida de água de rios contaminados, viagem
a áreas endêmicas (Russia, India, Rocky Mountains, etc.) e creches.
Morfologia
Trofozoíto:
Giardia tem 12 a 15 micrometros, é um organismo com formato
de meia pêra, com 8 flagelos e 2 axóstilos arranjados em simetria
bilateral. Existem dois discos de sucção grandes localizados
anteriormente. O citoplasma contém dois núcleos e dois corpos
parabasais (Figura 7).
Cisto:
Cistos de Giardia são células elipsoidais com 9 a 12
micrômetros com uma parede lisa e bem definida. O citoplasma contém
quatro núcleos e muitas das estruturas vistas no trofozoíto.
Ciclo de vida
(Figura 6)
A infecção ocorre pela ingestão dos cistos, normalmente em águas
contaminadas. A desencistação ocorre no duodeno e os trofozoítos (trofs)
colonizam o intestino delgado superior onde eles nadam livremente ou
aderem ao epitélio submucoso via disco de sucção ventral. Os
trofozoítos livres encistam durante seu trajeto a mitose ocorre
durante o encistamento. Os cistos são eliminados com as fezes. O
homem é o hospedeiro primário, embora castores, porcos e macacos
também sejam infectados e servem como reservatórios.
|
|
Figura
6
|
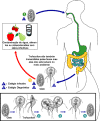 Ciclo de vida de
Giardia lamblia
Ciclo de vida de
Giardia lamblia
Os cistos são responsáveis pela transmissão da giardíase. Cistos e
trofozoítos podem ser encontrados nas fezes (Disgnóstico dos estágios)
 .
Os cistos são endurecidos, podem sobreviver alguns meses em água fria. A
infecção ocorre pela ingestão dos cistos em água contaminada, alimentos
e pela rota oral-fecal (mãos e utensílios) .
Os cistos são endurecidos, podem sobreviver alguns meses em água fria. A
infecção ocorre pela ingestão dos cistos em água contaminada, alimentos
e pela rota oral-fecal (mãos e utensílios)
 .
No intestino delgado a excistação libera trofozoítos (cada cisto produz
dois trofozoítos) .
No intestino delgado a excistação libera trofozoítos (cada cisto produz
dois trofozoítos)  .
Os trofozoítos se multiplicam por fissão binária, permanecendo no lúmen
do intestino delgado proximal, onde podem estar livres ou aderidos à
mucosa pelo disco de sucção ventral .
Os trofozoítos se multiplicam por fissão binária, permanecendo no lúmen
do intestino delgado proximal, onde podem estar livres ou aderidos à
mucosa pelo disco de sucção ventral  .
A encistação ocorre à medida que os parasitas transitam em direção ao
cólon. O cisto é o estágio encontrado mais comumente nas fezes não
diarrêicas .
A encistação ocorre à medida que os parasitas transitam em direção ao
cólon. O cisto é o estágio encontrado mais comumente nas fezes não
diarrêicas
 .
Devido à infectividade dos cistos quando passam pelas fezes e até certo
tempo após, é possível a transmissão pessoa a pessoa. Animais são
infectados com Giardia, mas a sua importância como reservatório
não está muito clara. .
Devido à infectividade dos cistos quando passam pelas fezes e até certo
tempo após, é possível a transmissão pessoa a pessoa. Animais são
infectados com Giardia, mas a sua importância como reservatório
não está muito clara.
CDC
DPDx Biblioteca de
Imagens de Parasitas
|
| |
Sintomas
Os
sintomas iniciais incluem flatulência, distensão abdominal, náusea e
evacuações pútridas e explosivas, frequentemente líquidas, diarréia. As
fezes contém excesso de lipídios mas muito raramente sangue ou tecido
necrótico. O estado mais crônico está associado com mal absorção de vitamina
B12, deficiência de dissacaridase e intolerência à lactose.
Patologia
A
cobertura do epitélio intestinal pelos trofozoítos e achatamento da
superfície da mucosa leva à mal absorção de nutrientes.
Imunologia
Há
envolvimento de IgA e IgM e incidência aumentada de infecção em pacientes
imunodeficientes (ex. AIDS).
Diagnóstico
Sintomas, histórico e epidemiologia são usados no diagnóstico. A disenteria
causada por Giardia é distinta de outras disenterias devido à falta
de muco e sangue nas fezes, ausência de aumento de leucócitos PMN nas fezes
e ausência de febre alta. Cistos nas fezes e trofs (Figura 7) no duodeno
podem ser identificadas microscopicamente após material ser obtido usando
uma cápsula gelatinosa com um fio (Enterotest®). Trofs precisam
ser distinguidos do flagelado não patogênico Trichomona hominis, que
é um flagelado assimétrico com uma membrana ondulante.
Tatamento
Metronidazol é a droga escolhida.
|
|
Figura
7 |
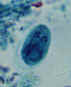
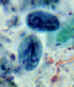
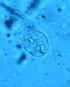 Cistos de Giardia lamblia, corado com hematoxilina férrica (A, B) e em
montagem líquida (C; de um paciente visto em Haiti). Tamanho: 8-12 µm em
comprimento. Esses cistos têm dois núcleos cada (os mais maduros têm
quatro). CDC
Cistos de Giardia lamblia, corado com hematoxilina férrica (A, B) e em
montagem líquida (C; de um paciente visto em Haiti). Tamanho: 8-12 µm em
comprimento. Esses cistos têm dois núcleos cada (os mais maduros têm
quatro). CDC

 Cisto de Giardia lamblia. Clorazol negro.
Cisto de Giardia lamblia. Clorazol negro.
CDC/Dr. George R. Healy

 Cisto de Giardia lamblia. Iôdo.
Cisto de Giardia lamblia. Iôdo.
CDC
DPDx Biblioteca de
Imagens de Parasitas
 Giardia lamblia. Coloração indireta do anticorpo. Teste positivo.
Giardia lamblia. Coloração indireta do anticorpo. Teste positivo.
CDC/Dr. Govinda S. Visvesvara gsv1@cdc.gov
 Giardia lamblia. Coloração indireta do anticorpo. Teste negativo.
Giardia lamblia. Coloração indireta do anticorpo. Teste negativo.
CDC/Dr. Govinda S. Visvesvara gsv1@cdc.gov
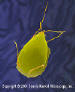 Giardia lamblia
– um parasita humano do trato gastrointestinal. O organismo é
disseminado por contato direto ou através de água e alimentos
contaminados. Giardia spp. tem forma de pêra, com flagelo capilar
que lhe confere mobilidade. Eles provocam a doença giardíase (ou
lamblíase), uma infecção do intestino delgado mais comum em áreas
tropicais. Giardia spp. se liga por meio de discos de sucção às
microvilosidades do intestino humano. Cólicas abdominais, inchaço,
diarréia e náusea podem ocorrer.
Giardia lamblia
– um parasita humano do trato gastrointestinal. O organismo é
disseminado por contato direto ou através de água e alimentos
contaminados. Giardia spp. tem forma de pêra, com flagelo capilar
que lhe confere mobilidade. Eles provocam a doença giardíase (ou
lamblíase), uma infecção do intestino delgado mais comum em áreas
tropicais. Giardia spp. se liga por meio de discos de sucção às
microvilosidades do intestino humano. Cólicas abdominais, inchaço,
diarréia e náusea podem ocorrer.
©
Dennis Kunkel Microscopy, Inc.
Usado com permissão
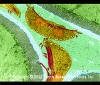 Infecção por protozoário no intestino humano (Giardia) sp.
Infecção por protozoário no intestino humano (Giardia) sp.
©
Dennis Kunkel
Microscopy, Inc.
Usado com permissão
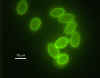 Giardia – Anticorpo Fluorescente (FA) Foto de coloração Por: H.D.A.
Lindquist, U.S. EPA
Giardia – Anticorpo Fluorescente (FA) Foto de coloração Por: H.D.A.
Lindquist, U.S. EPA
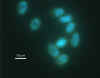 Coloração de Giardia por DAPI: Esta coloração permite a visualização dos
núcleos. Giardia e Criptosporídio têm até 4 núcleos que podem ser vistos
se intatos.
Coloração de Giardia por DAPI: Esta coloração permite a visualização dos
núcleos. Giardia e Criptosporídio têm até 4 núcleos que podem ser vistos
se intatos.
Photo Credit: H.D.A. Lindquist, U.S. EPA
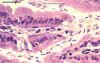
Trofozoítos de Giardia em seção de intestino (H&E)
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão.
|
| |
| |
OUTROS PROTOZOÁRIOS INTESTINAIS
Balantidium coli
e Cryptosporidium (parvum) são ambos protozoários zoonóticos que
causam infecções intestinas com alguma significância para a saúde.
Balantidium coli
Este é um parasita primariamente de bovinos, porcos e cavalos. O
organismo é grande (100 x 60 micrômetros) ciliado com um macro- e
micro- núcleo (Figura 8). A infecção ocorre na maioria das vezes em
trabalhadores de fazendas e outras áreas rurais pela ingestão de
cistos em material fecal de animais de fazenda. Transmissão homem a
homem é rara mas possível. Os sintomas e patogênese de balantidíase
são similares àqueles vistos em amebíase, incluindo erosão do
epitélio intestinal. Entretanto, abcesso de fígado, pulmões e
cérebro não são vistos. Metronidazol e iodoquinol são eficazes.
|
|
Figura
8 |
A
 B
B
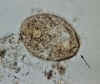 Trofozoítos de Balantidium coli. Estes são caracterizados por: seu
tamanho grande (40 µm a mais de 70 µm) , presença de cílios na
superfície celular – particularmente visível em (B) um citostome (setas) um
macronúcleo em forma de feijão que é frequentemente visível – ver (A), e
um micronúcleo menor, menos conspícuo. CDC
Trofozoítos de Balantidium coli. Estes são caracterizados por: seu
tamanho grande (40 µm a mais de 70 µm) , presença de cílios na
superfície celular – particularmente visível em (B) um citostome (setas) um
macronúcleo em forma de feijão que é frequentemente visível – ver (A), e
um micronúcleo menor, menos conspícuo. CDC
C
 Trofozoítos de Balantidium coli em secção de intestino (H&E)
Trofozoítos de Balantidium coli em secção de intestino (H&E)
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão.
D
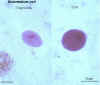 Cistos e trofozoíto de Balantidium coli
Cistos e trofozoíto de Balantidium coli
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão.
D
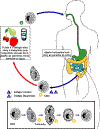 Ciclo de vida de
Balantidium coli
Ciclo de vida de
Balantidium coli
Os cistos são o estágio parasítico responsável pela transmissão de
balantidíase  .
O hospedeiro adquire o cisto mais frequentemente através da ingestão de
alimentos ou água contaminados .
O hospedeiro adquire o cisto mais frequentemente através da ingestão de
alimentos ou água contaminados  .
Após a ingestão, ocorre a excistação no intestino delgado, e os
trofozoítos colonizam o intestino grosso .
Após a ingestão, ocorre a excistação no intestino delgado, e os
trofozoítos colonizam o intestino grosso
 .
Os trofozoítos residem no lúmen do intestino grosso de humanos e animais,
onde se replicam por fissão binária, durante o qual pode ocorrer
conjugação .
Os trofozoítos residem no lúmen do intestino grosso de humanos e animais,
onde se replicam por fissão binária, durante o qual pode ocorrer
conjugação
 .
Os trofozoítos sofrem encistação para produzir cistos infectivos .
Os trofozoítos sofrem encistação para produzir cistos infectivos
 .
Alguns trofozoítos invadem as paredes do cólon e se multiplicam. Alguns
retornam ao lúmen e se desintegram. Cistos maduros são transmitidos nas
fezes .
Alguns trofozoítos invadem as paredes do cólon e se multiplicam. Alguns
retornam ao lúmen e se desintegram. Cistos maduros são transmitidos nas
fezes
 . .
CDC
DPDx
Biblioteca de
Imagens de Parasitas
|
| |
Cryptosporidium parvum
C.
parvum
é um
pequeno
parasita redondo medinto 3 a 5 micrômetros que é encontrado no trato
gastrointestinal de muitos animais e que causa diarréias epidêmicas em
humanos via alimentos e água contaminados (Figura 9). Humanos são infectados
pela ingestão dos oocistos de C. parvum contendo muitos esporozoítos.
Os esporozoítos são liberados no trato GI superior e aderem à mucosa
intestinal onde se dividem para produzir merozoítos. Os merozoítos invadem
outras células mucosas e posteriormente se multiplicam assexualmente. Alguns
dos merozoítos se diferenciam em gametócitos masculinos e femininos e formam
um oocisto e se multiplicam e diferenciam em esporozoítos. O oocisto maduro
é excretado com material fecal e infecta outros indivíduos (Figura 10).
Quando um
grande número de humanos em uma comunidade tem diarréia, a causa mais
provável é C. parvum. Um pequeno bolus de infecção pode provocar
diarréia amena, enquanto que uma injestão grande de organismos pode provocar
sintomas mais pronunciados, incluindo diarréia líquida copiosa, cólicas
abdominais, flatulência e perda de peso. A severidade e duração dos sintomas
estão relacionadas com a imunocompetência. Em pacientes com AIDS o organismo
pode causar diarréia severa e prolongada e os organismos podem invadir a
vesícula biliar, o trato biliar e o epitélio do pulmão. Não há tratamento
eficaz aprovado para criptosporidíase, embora paromicina seja usada como
droga sob investigação.
Há uma
variedade de testes baseados em anticorpos para a detecção mas muitos deles
detectam outras espécies de Cryptosporidium que não são C. parvum.
Testes sensíveis de reação em cadeia da polimerase estão disponíveis
para a detecção de C. parvum em amostras ambientais e animais.
|
|
Figura
9 |
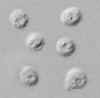 Oocistos de Cryptosporidium parvum, em montagem líquida, vistos com
microscopia de contraste diferencial (DIC). Os oocistos são redondos,
4.2 µm - 5.4 µm de diâmetro. Os esporozoítos estão visíveis dentro dos
oocistos, indicando que a esporulação já ocorreu. (Em comparação,
oocistos de Cyclospora cayetanensis, um outro parasida coccidiano de
humanos, são duas vezes maiores e não estão esporulados – não contém
esporocistos – na excreção) CDC
Oocistos de Cryptosporidium parvum, em montagem líquida, vistos com
microscopia de contraste diferencial (DIC). Os oocistos são redondos,
4.2 µm - 5.4 µm de diâmetro. Os esporozoítos estão visíveis dentro dos
oocistos, indicando que a esporulação já ocorreu. (Em comparação,
oocistos de Cyclospora cayetanensis, um outro parasida coccidiano de
humanos, são duas vezes maiores e não estão esporulados – não contém
esporocistos – na excreção) CDC
 Oocistos de Cryptosporidium parvum corado pelo método de coloração
“álcool-ácido resistência”. Contra um fundo azul-esverdeado os oocistos
aparecem em cor vermelha brilhante. Esporozoítos são visíveis dentro de
dois oocistos à direita. CDC
Oocistos de Cryptosporidium parvum corado pelo método de coloração
“álcool-ácido resistência”. Contra um fundo azul-esverdeado os oocistos
aparecem em cor vermelha brilhante. Esporozoítos são visíveis dentro de
dois oocistos à direita. CDC
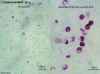 Oocistos de Cryptosporidium sp., não corados na coloração “álcool-ácido
resistência” modificada de Kinyoun
Oocistos de Cryptosporidium sp., não corados na coloração “álcool-ácido
resistência” modificada de Kinyoun
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão.
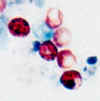 Oocistos de Cryptosporidium parvum corado pelo método de álcool-ácido
resistentes. Esta imagem mostra que a coloração pode ser variável. Uma
particularidade é que infecções que estão curando podem estar
acompanhadas de números crescentes de oocistos “fantasmas” não
álcool-ácido resistentes. CDC
Oocistos de Cryptosporidium parvum corado pelo método de álcool-ácido
resistentes. Esta imagem mostra que a coloração pode ser variável. Uma
particularidade é que infecções que estão curando podem estar
acompanhadas de números crescentes de oocistos “fantasmas” não
álcool-ácido resistentes. CDC
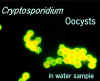 Estes oocistos estão corados com um anticorpo marcado com fluorescência,
o que torna a identificação mais fácil. Entretanto, muitos anticorpos
marcam todas as espécies de Cryptosporidium
Estes oocistos estão corados com um anticorpo marcado com fluorescência,
o que torna a identificação mais fácil. Entretanto, muitos anticorpos
marcam todas as espécies de Cryptosporidium
© AWPL, ARS, USDA
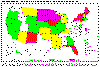 Casos relatados de Criptosporidiose, Estados Unidos 1997
Casos relatados de Criptosporidiose, Estados Unidos 1997
USFDA
|
|
Figura
10
|
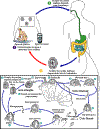
Ciclo de
vida do Criptosporídio (de: Juranek DD. Cryptosporidiosis. In: Hunter’s
Tropical Medicine, 8a edição. Strickland GT, Editor.)
Oocistos esporulados, contendo 4 esporozoítos, são excretados pelo
hospedeiro infectado através das fezes e possivelmente por outras rotas,
tais como secreções respiratórias  .
A transmissão do
Cryptosporidium parvum ocorre principalmente
pelo contato com água contaminada (ex., ingestão de bebidas ou de águas
de parques aquáticos). Ocacionalmente a partir de fontes alimentares,
tais como em salada de frango, que podem servir como veículo de
transmissão. Muitos surtos nos Estados Unidos têm ocorrido em parques
aquáticos, piscinas comunitárias e creches. A transmissão zoonótica do
C. parvum ocorre pela exposição de animais infectados ou
exposição a água contaminada pelas fezes de animais infectados .
A transmissão do
Cryptosporidium parvum ocorre principalmente
pelo contato com água contaminada (ex., ingestão de bebidas ou de águas
de parques aquáticos). Ocacionalmente a partir de fontes alimentares,
tais como em salada de frango, que podem servir como veículo de
transmissão. Muitos surtos nos Estados Unidos têm ocorrido em parques
aquáticos, piscinas comunitárias e creches. A transmissão zoonótica do
C. parvum ocorre pela exposição de animais infectados ou
exposição a água contaminada pelas fezes de animais infectados
 .
Após a ingestão (e possivelmente inalação) pelo hospedeiro adequado .
Após a ingestão (e possivelmente inalação) pelo hospedeiro adequado
 ,
ocorre a excistação ,
ocorre a excistação
 Os esporozoítos são liberados e células epiteliais (
Os esporozoítos são liberados e células epiteliais ( , ,
 )
do trato gastrointestinal ou de outros tecidos como o trato respiratório.
Nessas células, os parasitas realizam multiplicação assexual (esquizogonia
ou merogonia) ( )
do trato gastrointestinal ou de outros tecidos como o trato respiratório.
Nessas células, os parasitas realizam multiplicação assexual (esquizogonia
ou merogonia) ( , ,
 , ,
 )
e depois multiplicação sexual (gametogonia) produzindo microgamontes
(machos) )
e depois multiplicação sexual (gametogonia) produzindo microgamontes
(machos)  e macrogamontes (fêmeas)
e macrogamontes (fêmeas)
 .
Com a fertilização dos macrogamontes pelos microgametas ( .
Com a fertilização dos macrogamontes pelos microgametas ( ),
oocistos ( ),
oocistos ( , ,
 )
se desenvolvem e esporulam no hospedeiro infectado. Dois tipos
diferentes de oocistos são produzidos, o de parêde espêssa, que é
comumente excretado do hospedeiro )
se desenvolvem e esporulam no hospedeiro infectado. Dois tipos
diferentes de oocistos são produzidos, o de parêde espêssa, que é
comumente excretado do hospedeiro
 ,
e o oocisto de parêde fina ,
e o oocisto de parêde fina
 ,
que é primáriamente envolvido na autoinfecção. Oocistos são infectivos
na excreção, permitindo assim transmissão direta e imediata oral-fecal. ,
que é primáriamente envolvido na autoinfecção. Oocistos são infectivos
na excreção, permitindo assim transmissão direta e imediata oral-fecal.
Note que oocistos de
Cyclospora cayetanensis,um outro parasita
aoccidiano importante, são não esporulados na época da excreção e não se
tornam infectivos até que a esporulação seja completada. Veja o ciclo de
vida da Cyclospora cayentanensis para maiores detalhes.
CDC
DPDx Parasita Image
Library
|
| |
Isospora belli
I. belli
é infecção rara em humanos normais, embora tenha sido visto em
números aumentados em pacientes de AIDS . A infecção ocorre via rota
oro-fecal. O estágio infectivo do organismo é um oocisto oval (Figura
11) que, na ingestão, segue o mesmo curso do C. parvum. A
doença produz sintomas similares àqueles da giardíase. Em indivíduos
normais, infecções amenas se resolvem por si mesmas com repouso e
dieta simples e infecções mais intensas podem ser tratadas com sulfa.
O tratamento deve ocorrer por um período prolongado em pacientes de
AIDS.
|
|
Figura
11
|
A
 B
B
 C
C
 Oocistos de Isospora belli. Os oocistos são grandes (25 a 30 µm) e tem
uma forma típica elipsóide. Quando excretado, são imaturos e contém um
esporoblasto (A, B). O oocisto matura após a excreção: O esporoblasto
único divide em dois esporoblastos (C), que desenvolve parêdes císticas,
tornando-se esporocistos, que eventualmente contém quatro esporozoítos
cada. Imagens de contribuição por Georgia Division of Public
Health/CDC
DPDx Biblioteca de
Imagens de Parasitas
Oocistos de Isospora belli. Os oocistos são grandes (25 a 30 µm) e tem
uma forma típica elipsóide. Quando excretado, são imaturos e contém um
esporoblasto (A, B). O oocisto matura após a excreção: O esporoblasto
único divide em dois esporoblastos (C), que desenvolve parêdes císticas,
tornando-se esporocistos, que eventualmente contém quatro esporozoítos
cada. Imagens de contribuição por Georgia Division of Public
Health/CDC
DPDx Biblioteca de
Imagens de Parasitas
|
| |
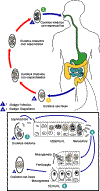
Ciclo de
vida de Isospora belli
No momento da excreção, os oocistos imaturos contém normalmente um
esporoblasto (raramente dois)  .
Em maturações posteriores após a excreção, o esporoblasto se divide em
dois (o oocisto agor contém dois esporoblastos); os esporoblastos
secretam uma parêde de cisto, tornando-os assim esporocistos; e os
esporocistos se dividem duas vezes para produzir quatro esporozoítos
cada .
Em maturações posteriores após a excreção, o esporoblasto se divide em
dois (o oocisto agor contém dois esporoblastos); os esporoblastos
secretam uma parêde de cisto, tornando-os assim esporocistos; e os
esporocistos se dividem duas vezes para produzir quatro esporozoítos
cada
 .
A infecção ocorre pela ingestão de oocistos contendo esporocistos: os
esporocistos desencistam no intestino delgado e liberam seus
esporozoítos, que invadem células epiteliais e iniciam esquizogonia .
A infecção ocorre pela ingestão de oocistos contendo esporocistos: os
esporocistos desencistam no intestino delgado e liberam seus
esporozoítos, que invadem células epiteliais e iniciam esquizogonia
 .
Com a rutura dos esquizontes, os merozoítos são liberados, invadem novas
células epiteliais, e continuam o cliclo da multiplicação assexual .
Com a rutura dos esquizontes, os merozoítos são liberados, invadem novas
células epiteliais, e continuam o cliclo da multiplicação assexual
 .
Trofozoítos se desenvolvem em esquizontes que contém múltiplos
merozoítos. Após um mínimo de uma semana, o estágio sexual se inicia com
o desenvolvimento de gametócitos masculinos e femininos .
Trofozoítos se desenvolvem em esquizontes que contém múltiplos
merozoítos. Após um mínimo de uma semana, o estágio sexual se inicia com
o desenvolvimento de gametócitos masculinos e femininos
 .
A fertilização leva ao desenvolvimento de oocistos que são excretados
nas fezes .
A fertilização leva ao desenvolvimento de oocistos que são excretados
nas fezes
 . Isospora
belli
infecta tanto humanos como animais. . Isospora
belli
infecta tanto humanos como animais.
CDC
DPDx Biblioteca de
Imagens de Parasitas
|
| |
PROTOZOÁRIOS LUMINAIS
TRICOMONÍASE
Etiologia
Trichomonas vaginalis
(um flagelado)
Epidemiologia
Trichomonas vaginalis
tem distribuição mundial; a incidência mínima é de 5% em fêmeas normais e
máxima de 70% entre prostitutas e prisioneiras.
Morfologia
A
forma em trofozoíto tem 15 a 18 micrômetros em diâmetro e tem forma de meia
pêra com um único núcleo, quatro flagelos anteriores e um flagelo lateral
adaptado por uma membrana ondulante. Dois axóstilos estão arrajnagos
assimetricamente (Figura 12).O organismo não encista.
Ciclo de
vida
T. vaginalis
coloniza a vagina de mulheres e a uretra (às vezes próstata) de homens. A
infecção ocorre primariamente via contato sexual, embora infecções não
venéreas sejam possíveis. O organismo não encista e se divide por fissão
binária que é favorecida pela baixa acidez (pH > 5.9; o pH normal é 3.5 a
4.5). Não existe reservatório não humano.
Sintomas
A infecção por T. vaginalis
é raramente sintomática em homens, embora possa causar uretrite leve ou
ocasionalmente prostatite. Em mulheres é frequentemente assintomática, mas
infecções intensas em um pH elevado pode causar vaginite leve a severa com
corrimento amarelado copioso e de odor pútrido, às vezes espumante (Figura
12).
Patologia
O organismo
provoca lesão de contato ao epitélio do órgão infectado.
Diagnóstico
Suspeita clínica deve ser confirmada ao encontrar o organismo em esfregaços
corados com Giemsa (Figura 12) de corrimento vaginal ou, em casos
difíceis, pelo cultivo de uma amostra em meio de Diamond. Trofozoítos devem
ser distinguidos do flagelado não patogênico Trichomona hominis.
Tratamento
Metronidazol (embora seja teratogênico) é eficiente para homens e mulheres.
Ducha de vinagre pode ser útil. Higiene pessoal e o uso de condons ajuda.
|
|
|
|
Figura 12
|
 Trofozoítos de Trichomonas vaginialis
Trofozoítos de Trichomonas vaginialis
CDC
DPDx
Biblioteca de
Imagens de Parasitas
 Trichomonas vaginialis - Trofozoítos
Trichomonas vaginialis - Trofozoítos
CDC
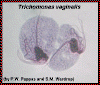 Dois trofooítos de Trichomonas vaginalis de uma cultura. Os quatro
flagelos e núcleos únicos são visíveis. O bastão mediano escuro é o
axóstimo que é característico de tricomonídios.
Dois trofooítos de Trichomonas vaginalis de uma cultura. Os quatro
flagelos e núcleos únicos são visíveis. O bastão mediano escuro é o
axóstimo que é característico de tricomonídios.
© Ohio State University/P.W. Pappas/S.M. Wardrop
 T.
vaginalis – Corrimento vaginal
T.
vaginalis – Corrimento vaginal
CDC
 Tricomonas- Secreção vaginal corada
Tricomonas- Secreção vaginal corada
CDC
Trofozoíto de Trichomonas vaginalis, coloração Pap
©
Dr Peter Darben,
Coleção de parasitologia clínica da “Queensland University of
Technology”. Usado com permissão.
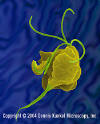 Trichomonas vaginalis
– Protozoário parasita que causa tricomoníase (fase vegetativa chamada
trofozoíto).
Trichomonas vaginalis
– Protozoário parasita que causa tricomoníase (fase vegetativa chamada
trofozoíto).
©
Dennis Kunkel Microscopy, Inc.
Usado com permissão
|
| |
|
Figura
13 |
 Ciclo de vida de Trichomonas vaginalis
Ciclo de vida de Trichomonas vaginalis
Trichomonas vaginalis reside no trato genital inferior de uma mulher
e na uretra e próstata de um homem
 ,
onde replica por fissão binária ,
onde replica por fissão binária
 .
O parasita não parece ter uma forma cística, e não sobrevive bem no meio
externo. Trichomonas vaginalis é transmitida entre seres humanos,
seu único hospedeiro, primariamente pela relação sexual .
O parasita não parece ter uma forma cística, e não sobrevive bem no meio
externo. Trichomonas vaginalis é transmitida entre seres humanos,
seu único hospedeiro, primariamente pela relação sexual
 . .
DPDx Parasita Image
Library
|
| |
|
Sumário |
|
Organismo |
Transmissão |
Sintomas |
Diagnóstico |
Tratamento |
|
Entameba histolytica
|
Oro-fecal |
Disenteria com sangue e tecido necrótico.
Crônicos: abcessos |
Fezes: cistos com 1-4 núcleos e/ou trofs.
Trofs em aspirado. |
GI: Iodoquinol ou
Metronidazol
Abcesso: Metronidazol |
|
Giardia lamblia
|
Oro-fecal |
Odor pútrido, diarréia bruta; raramente sangue ou tecido necrótico. |
Fezes: trofozoíto de giárdia madura típico e/ou cisto. |
Iodoquinol ou Metronidazol. |
|
Balantidium coli
|
Oro-fecal; zoonótica |
Disenteria com santue e tecido necrótico mas não abcessos. |
Fezes: trofs ciliados e/ou cistos. |
Iodoquinol ou Metronidazol. |
|
Cryptosporidium parvum
|
Oro-fecal |
Diarréia |
Oocistos em fezes |
Paromicina (sob investigação) |
|
Isospora belli |
Oro-fecal |
Do tipo Giardíase |
Oocistos em fezes |
Sulfa |
|
Trichomonas
vaginalis |
Sexual
|
Vaginite; ocasional uretrite/prostatite. |
Flagelado em esfregado vaginal (ou uretral). |
Mebendazol; ducha de vinagre; esteróides |
|
|
|
 Voltar à Seção de Parasitologia de Microbiologia e Imunologia On-line
Voltar à Seção de Parasitologia de Microbiologia e Imunologia On-line
Página mantida por
Richard Hunt
|





































































