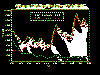|
ÖĞRETİM HEDEFLERİ
Rhabdovirüslerin farklı tiplerini bilmek
Bu negatif zincirli RNA virüslerinin yapısı ve replikasyonu hakkında
bilgi edinmek
Kuduz patolojisini anlamak
|
Kuduz virüsü Rhabdoviridae (Yunanca; Rhabdos: çubuk) ailesine aittir.
Rhabdoviridae çeşitli hayvan ve bitkileri enfekte edebilir.
İnsan hastalıkları ile ilgili olarak en önemli rabdovirüs kuduz virüsü olup
dünya çapında, her yıl yaklaşık 55.000 kişinin kuduzdan öldüğü tahmin
edilmektedir. CDCye göre, bildirilen hayvan kuduz vakalarının çoğu(% 90'dan
fazla) yabani hayvanlarda meydana gelmektedir; oysa 1960dan önce çoğu evcil
hayvanlarda görülmekteydi. Bugün için başlıca kuduz konağı yabani etoburlar ve
yarasalardır. Amerika Birleşik Devletleri'nde kuduza bağlı insan ölümlerinin
sayısı, 1900 yılında yıllık 100'den yüzyılın sonuna gelindiğinde yılda bir ya da
ikiye kadar düşmüştür. Bu ölümler genellikle yerel kuduz yarasa, kokarca veya
rakunlara ya da yurtdışı seyahatlerinde kuduz köpeklere maruz kalmaya bağlıdır.
Modern profilaksi neredeyse % 100 başarılı olmaktadır.
|
TABLO 1
Rhabdoviruslar |
|
Tip |
Virus |
Dağılım |
İnfekte türler |
Hastalık |
| Vezikülovirüs |
Veziküler stomatit virüsü (VSV) |
Karayipler |
Sığır, domuz, at |
Akut, kendi kendini sınırlayan |
| Lissavirüs |
Kuduz virüsü |
Dünya genelinde |
İnsanlar dahil olmak üzere birçok memeli |
Yavaş, ilerleyici |
| Bitki rabdovirüsleri
Sitorabdovirüs |
Lettuce
necrotic yellows virus |
|
|
|
| Nükleorabdovirüs |
Potato yellow dwarf virus |
|
|
|
| Diğer hayvan rabdovirüsleri |
|
|
Memeliler, balık, kuş, artropodlar |
|
|
TABLO 2
Enfekte hayvanlardan rapor edilen diğer (kuduz dışı) lissaviruslar |
|
Virus |
Ülke ve enfeksiyon yılı |
Vektör hayvan |
| Avustralya yarasa
Lissavirüsü |
Avustralya -
1996/97 |
Yarasalar |
| Avrupa yarasa
lissavirüs-1 |
Rusya 1985 |
Yarasalar |
| Avrupa yarasa
lissavirüs-2 |
Finlandiya - 1985
İskoçya 2002 |
Yarasalar |
| Duvenhage |
Güney Afrika -
1970/2006
Kenya 2007 |
Yarasalar |
| Mokola |
Nijerya - 1968/71 |
Tanımlanmadı |
| Diğer
tiplendirilemeyenler |
Ukrayna - 1977
Çin - 2002
Ukrayna 2002 |
Yarasalar |
|
 Şekil 1A
Şekil 1A
Rhabdovirus yapısı Genel rhabdovirus yapısı
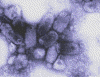 Şekil 1B
Şekil 1B
Rabies virusun negatif boyamalı elektron mikrografisi
Wadsworth Center, NY Dept of Health
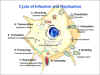 Şekil 2
Şekil 2
Kuduz virüsunun replikasyonu. Kuduz enfeksiyonu ve replikasyon döngüsü
CDC |
RHABDOVIRUSLARIN YAPISI (Şekil
1) Rabdovirusler viral proteinleri kodlamada gerekli mesajcı RNA için
anti-sens(zıt anlamlı) olan tek negatif zincirli RNA virüsleridir. Bu da
RNAnın doğrudan protein sentezi için kodlanamadığı ve pozitif iplikli
mRNA kopyalanmasına ihtiyaç olduğu anlamına gelir. Bunun sonucu olarak,
virüs kendi RNA-bağımlı RNA polimerazını taşımak zorundadır.
İsminden de anlaşıldığı gibi bu virüsler çubuk şeklindedir. Bir uçları
yuvarlak sonlanır ve genellikle mermi biçimli olarak anılırlar. Her
virüs parçacığı 100nm çapında ve 400nm boyundadır, ancak bu çok
değişkendir. Konak hücre plazma zarından türetilmiş bir zarfa
sahiptirler. Virüsün yalnızca beş proteini mevcuttur.
G (Yüzey) Proteini
Yüzey glikoprotein çıkıntılarıdır ve trimerler oluşturur. Her
virüs partikülü başına yaklaşık 1200 G protein (400 trimer)
mevcuttur. N-terminal sinyal dizisine sahip bir transmembran
proteinidir. G proteini hücresel reseptörlere bağlanır ve nötralizan
antikorların hedefidir. N-glikozidik bağlı üç şeker zincirleri
vardır. Sitoplazmaya virüs penetrasyonu endositik yolakla olup
plazma membranından gerçekleşmez. Bu, G protein stabilizasyonunu
sağlayan trimer yapısının pH 6.1'de değişikliğe uğradığı içindir ve
muhtemelen molekülün hidrofobik bölgesinin açığa çıkarak enfekte
edeceği hücrenin zarına gömülmesine izin verir.
M (matrix) proteini
Halen biraz tartışmalı olmakla birlikte, viral membran iç
yüzeyinde bir hat görünümündeki çevresel membran proteinidir (önceden
M membranı temsil etmekteydi). Membran veya G proteini ile
nükleokapsid arasında bir köprü görevi üstlenebilmektedir.
Nukleokapsid
Virüsün enfektif ribonükleoprotein çekirdeğidir. Mebran içinde
yer alan helikal bir yapıdır. Şekil 1de görüldüğü gibi negatif
boyanmış elektron mikrografında, nükleokapsid çizgili bir görünüme
sahiptir.
N (Nükleoprotein) proteini
Majör yapısal bir proteindir ve RNA genomunu sarar. Genomu
nükleazlardan korur ve transkripsiyonu sağlayan uygun bir
konformasyonda tutar.
L (Geniş) proteini ve
NS (yapısal olmayan, diğer adıyla P (fosfo)
olarak bilinen) proteini
Birlikte RNA-bağımlı RNA polimeraz ve transkriptazı oluşturur. L
proteini 240 kiloDalton molekül ağırlığına sahiptir ve geni
genomunun% 60 kadarını oluşturur(Şekil 3).
|
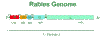 Şekil 3
Şekil 3
Rhabdovirus genomu
CDC |
REPLIKASYON (Şekil
2)
Bağlanma Rabdovirüsler
reseptörleri henüz kesin olarak tespit edilememişse de, bazı deneyler hücre
yüzeyi reseptör molekülleri olarak, fosfolipidleri, özellikle de fosfatidil
serini işaret etmektedir.
Penetrasyon
Endositozdan sonra pH bağımlı endositik vezikül membranı ile füzyon
meydana gelir. Nükleokapsid sitoplazmaya girer. Tüm sonraki aşamalar
hücrenin çekirdeğiyle hiçbir ilişki olmadan burada gerçekleşir.
Transkripsiyon İçeri giren
virüs içinde taşınan polimeraz, ilk olarak her viral protein için bir tane
olmak üzere beş ayrı mRNA yapar. Unutulmamalıdır ki, RNA tüm viral protein
sentezlerinden önce yapılmalıdır ve bu yüzden enfekte eden virüs polimeraz
enzimini sağlamak zorundadır. (Tahmin edilebileceği gibi, bu birincil
transkripsiyon işlemi protein sentezi inhibitörleri varlığında gerçekleşir).
mRNA'lar, metilenmiş ve poliadenilatlanmışlardır. mRNAların sentezinin her
bir gen bağlantı noktasında zayıflamasıyla N, NS (P), E, Gve L
transkripsiyon dizileri oluşur(Şekil 3). Bu da L mRNAnın diğerlerinden daha
az yapıldığı anlamına gelir.
Replikasyon
Ek olarak, polimeraz negatif anlamlı genomik RNAyı pozitif anlamlı zincire
dönüştürür. Bu, transkriptaz için yeni negatif anlamlı genomik RNA
molekülleri transkripsiyonunda şablon olarak kullanılır. Bu replikatif faz
protein sentezini gerektirir ve aynı polimeraz tarafından gerçekleştirilir.
Replikatif aşamada, bu enzim herbir mRNA türlerini tanımlayan sinyalleri yok
saymak ve tek bir RNA molekülü yapmak zorundadır. mRNA transkripsiyonu ile
genomik RNA replikasyonu arasındaki değişim N protein seviyesi ile kontrol
ediliyor gibi görünmektedir.
Birleşme G protein mRNA translasyonu endoplazmik retikulumla
ilişkili olarak yapılır ve hücre yüzeyine golgi cisimciği üzerinden taşınır.
Burada, M proteini ile ilişkili parçalar oluşturur. N, L ve NS (P)
proteinleri ile ilişkili genomik uzunluktaki negatif iplikli RNA molekülleri
çekirdek nükleokapsidini oluşturur. Bu da, plazma membranının iç yüzeyindeki
ya da belki de sitoplazmadaki M proteini ile ilişki kurar. nükleokapsid ve M
protein arasındaki etkileşim önceki yapının değişmesine ve daha yoğun
görünüm almasına neden olur. Daha sonra nükleokapsid mebrandan tomurcuklanır.
|
| |
PATOGENEZ
VEZİKÜLER STOMATİT VİRÜSÜ(VSV)
VSV Karayipler'de ve bazen de ABD'de sığırları enfekte eder. Ayrıca,
atlar ve domuzlarda görülür ancak insanlarda nadirdir.
KUDUZ
Bulaşma
Kuduz hayvanlarda agresif seyreder ve virüs tükürükte sekrete olur
dolayısıyla bulaş sıklıkla hayvan ısırıkları aracılığı ile olur. Nadir
durumlarda, ısırık olmadan, kuduz korneal transplant ya da diğer
dokuların nakli veya mukoza membranların ya da açık bir yaranın enfekte
tükürük ile teması yoluyla geçebilir. CDC: "Aerosol halindeki kuduz
virüsü inhalasyonu ısırık dışı potansiyel maruziyet yollarından biridir,
ancak laboratuvar çalışanları dışında, çoğu insanın kuduz virüsü
aerosolüyle karşılaşması pek mümkün değildir" şeklinde bildirmektedir.
İnsanların enfekte yarasa mağaralarında aerosol halindeki virüse maruz
kalabileceği öne sürülmüştür. Çoğu yarasa enfekte değildir.
Hastalık
Virüs nikotinik asetilkolin reseptörleri üzerinden inokülasyon
bölgesindeki sinir veya kas hücrelerine bağlanır. Burada virüs uzun bir
zaman için (birkaç aya kadar) kalabilir. Virüs hiçbir belirgin semptom
oluşturmadan ısırık yerindeki kas hücrelerinde replike olabilir. Bu
kuluçka aşamasıdır.
Virüs daha sonra sinir aksonları boyunca retrograd yolla taşınarak
merkezi sinir sistemine ilerler. Virüs dorsal kök ganglionuna ve
omuriliğe ulaşır. Buradan beyne yayılım gerçekleşir. Serebellumdaki
Purkinje hücrelerinden hipokampus ve pons çekirdeğindeki hücrelere kadar
beyindeki birçok hücre enfekte olabilir. Bu prodromal aşamadır. Beynin
enfekte olması ensefalite ve nöral dejenerasyona yol açarken sitopatik
etkisine nazaran virüsün diğer yerlerde etkisi azdır. Beyin tutulumu
koma ve ölüme yol açar. Bu nörolojik aşamadır ve bu dönemde virüs
nöronlar yoluyla merkezi sinir sisteminden cilt, göz ve çeşitli diğer
bölümlere (adrenaller, böbrekler, pankreatik asiner hücreler) ve tükürük
bezlerine yayılabilir (Şekil 4).
Semptomatik kuduzun başlama zamanını belirleyen çeşitli faktörler
vardır ancak en önemlileri enfeksiyondaki virüs parçacıklarının miktarı
ve ısırığın beyne ne kadar yakın olduğudur. Hastanın bağışıklık durumu
da önemlidir. Unutulmamalıdır ki, doğadan edinilen virüse karşı immün
yanıt yavaştır ve sağkalım için çok geç olan virüsün beyne ulaşmasına
kadar iyi bir nötralize edici yanıt görülmez. Hücre aracılı bağışıklık,
kuduz enfeksiyonunda küçük bir rol oynamaktadır. Kuduz hemen her zaman
ölümcüldür ve semptomatik kuduzdan kurtulan sadece üç kişi
bildirilmiştir. Bununla birlikte, uzun inkübasyon aşaması nedeniyle,
enfekte olduktan sonra bile kullanılacak aşı ile enfeksiyonu elimine
edecek iyi bir immün yanıt elde edilebilir.
Epidemiyoloji
Kuduz, genellikle bir hayvan ısırığı ile bulaşır. Dünya çapında çoğu
vaka köpek ısırığından kaynaklanmaktadır. Köpek kuduzu Latin Amerika,
Asya ve Afrika'da yaygındır.
Son yıllarda, ABD'deki vakaların çoğunluğu (47nin 35i) yarasa
kuduzu ile ilişkilendirilmiştir; kalan olguların iki tanesi ABDden (biri
köpek/çakal benzeri türden ve biri rakun türünden) ve 10 tanesi ABD
dışından ( tümü köpek/çakal benzeri türden) kaynaklanmıştır.
ABD'de rakunlar (özellikle doğu kıyısı devletlerinde), kokarcalar,
çakallar ve tilkiler dahil olmak üzere birçok hayvan kuduz virüsleri ile
enfektedir. Küçük kemirgenler nadiren enfekte olurlar, ancak özellikle
dağ sıçanlarında bildirilen vakalar olmuştur. Köpekler, kediler ve
sığırlar potansiyel vektörlerdir - ABDde evcil hayvanların
bağışıklanması yabani hayvanlardan kuduz bulaşma riskini azaltmıştır.
Çoğu yarasa enfekte olmamasına rağmen kuduz taşır. Yarasalar çok küçük,
keskin dişlere sahiptir ve ısırılan kişiler farketmeyebilir ya da bu
konuda herhangi bir şey yapma gereği duymayabilirler. Diğer kuduz hayvan
ısırıklarında, hayvan daha şüpheli davranışlar gösterdiği ve ısırık daha
ciddi olduğu için kurban genellik tedavi talep etmektedir; farkındalık
düzeyi kuşkulu davranan yarasalar için daha düşük görünmektedir. Evcil
hayvan immünizasyonu ve şüpheli hayvan ısırıklarına karşı hızlı bellek
yanıt, son yıllarda neden yarasa geçişli kuduzların baskın bulaş yolu
haline geldiğini açıklayabilmektedir.
Yarasa ilişkili kuduz vakalarının çoğunda kaydedilmiş bir ısırık
yoktur. Bazı durumlarda, mağdur veya onların aileleri bir yarasaya temas
ettiklerinin ya da o yarasada garip davranışlar bulunduğunun (Örn:
gündüz aktif olan, kolayca yakalanabilen, oda, ev içinde ya da çim
üzerinde uçamayan yarasa) farkında olabilir. Ancak kurban soruları
cevaplayacak durumda değilse olaydan herhangi birine bahsetmeye değer
bulmamış olabilecekleri için, yarasa temas öyküsünü elde etmek zor
olabilir.
Az sayıdaki kornea nakil olgularında insandan insana bulaşma meydana
gelmiştir. (Ensefalitin kuduz nedeniyle olduğunun fark edilmediğinde).
Bu, ensefalitli potansiyel donörlerin taranmasında, kuduza (veya
Creutzfeld-Jakob hastalığına) bağlı olanların kabul edilmediği, daha
sıkı kriterler getirilmesine yol açmıştır. Yakın dönemde, beyin
kanamasından ölen ve aynı zamanda kuduz olan bir organ donörü 4 alıcıya
bunu bulaştırmıştır. Organ nakli vakaları dışında kanıtlanmış hiç
insandan-insana bulaş yoktur.
|
Tablo 3
Kuduzun majör hayvan rezervuarları |
| Kuzey Amerika |
Kokarcalar, rakunlar,
yarasalar, tilkiler |
| Güney Amerika |
Kuduz köpekler, kan emici
yarasalar |
| Avrupa |
Porsuklar, tilkiler |
Kuduzun endemik olduğu pek çok batı ülkesinde, hayvanların aşılanması
insan hastalıklarının oranını düşürmüş ve Amerika Birleşik
Devletleri'nde insan kuduzu yaklaşık yılda bir olmuştur. Vahşi hayvan
popülasyonunda kuduz görülmeyen Birleşik Krallık gibi ülkelerde aşılama
kullanılmamaktadır. Diğer bazı ülkelerde, kuduz daha büyük bir sorundur.
Örneğin, Hindistanda başlıca köpek ısırıklarından olmak üzere yılda
yaklaşık 25.000 insan kuduz vakası kaydedilmektedir. Güney Amerika'da,
kan emici yarasalar tarafından kuduz bulaşı sığır endüstrisi için önemli
bir sorundur (Tablo 3).
|
|
WEB RESOURCES
CDC Rabies Page |
|
Şekil 4
Kuduz patogenezi
 CDC CDC
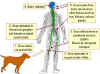
1. Kuduz bir hayvan tarafından ısırılan bir rakun
2. Virus tükürük ile yaradan girer
3. Virus omurilik ve beyne sinirler yoluyla yayılır
4. Hiçbir belirti olmadan 3-12 hafta kuluçka dönemi
5. Beyinde virus çoğalır ve tükürük bezleri de dahil olmak üzere diğer
dokulara yayılır. Hastalığın belirtileri ortaya çıkar
6. Hayvan bir hafta içinde ölür
Richard Hunt
|
|
|
Semptomlar
Aşı, maruz kalındıktan sonra bile,
hastalığın önlenmesinde son derece etkilidir. Böyle bir tedavi
olmaksızın kuduz hemen her zaman ölümcüldür (Solda görünen olgu raporuna
karşın). İnkübasyon/prodromal dönem belirtileri: yara yerinde ağrı ya da
kaşıntı, ateş, baş ağrısı ve sindirim sistemi sorunlarını kapsar. Bu
süreden sonra (genellikle iki hafta kadar), merkezi sinir sistemi
enfeksiyonu belirgindir. Hastaların yaklaşık yarısında, hidrofobi
görülmektedir. Bu su korkusu, içmeyle ilişkili ağrının sonucudur. Ayrıca
nöbet ve halüsinasyonlar vardır. Bazı hastalarda felç tek belirtidir ve
bu solunum yetmezliğine yol açabilir. Nörolojik aşamayı takiben, hasta
komatöz hale gelir. Solunum felci gibi nörolojik sorunlar nedeniyle ölüm
gerçekleşir.
|
|
VAKA RAPORU
Klinik kuduzdan bir hastanın iyileşmesi--- Wisconsin, 2004
Organ
Bağış ve Nakil Alıcılarında Kuduz Enfeksiyonlarının Araştırılması
|
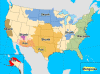
2010 yılında Amerika Birleşik Devletleri'nde karasal kuduz rezervuar
haritası. Bir rakun kuduz virüsü varyantı doğu ABD'de Skunk kuduz,
Merkez Amerika Birleşik Devletleri ve Kaliforniya, tilki kuduz Teksas,
Arizona ve Alaska, ve Firavun faresi kuduz Porto Riko'da mevcut.
CDC
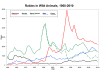
1960-2010 arası ABD'de bildirilen vahşi hayvanların kuduz grafiği
|
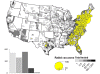
2010 yılında Amerika Birleşik Devletleri'nde bildirilen kuduz rakun
haritası. Olguların çoğunluğu doğu Amerika Birleşik
Devletleri'ndedir.
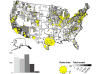
2010 yılında Amerika Birleşik Devletleri'nde bildirilen kuduz yarasa
haritası. Olgular geniş ABD boyunca dağılır.
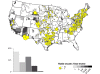
2010 yılında Amerika Birleşik Devletleri'nde bildirilen kuduz
kokarca haritası. Olguların çoğunluğu doğu ve orta Amerika Birleşik
Devletleri'ndedir
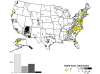
2010 yılında Amerika Birleşik Devletleri'nde bildirilen kuduz tilki
haritası. Olgular doğu ABD boyunca dağılır.

2010 yılında Amerika Birleşik Devletleri'nde bildirilen kuduz kedi
ve köpek haritası

Rakun Kuduzun Epizootik genişlemesi , Doğu Amerika Birleşik
Devletleri, 1977-1996
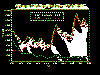
Amerika Birleşik Devletleri'nde hayvan kuduz vakaları, 1955-1999
Şekil 5 (All images from CDC)
|
| |
| |
| |
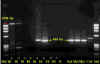 Şekil 6
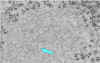
Şekil 6
Kuduz virusu varlığı için PCR testi sonuçları. Oklar pozitif bantların
pozisyonlarını göstermektedir
CDC |
Tanı
Hayvan ısırığına maruz kalan insanda aşikar belirtileriyle kolay
tanınabilen semptomatik kuduz evresinde terapötik müdahale için artık
çok geçtir. Isırıktan sonra, laboratuvar testleri hayvanın gerçekten
kuduz olup olmadığını saptayabilir. Bir hayvan veya enfekte kişide kuduz
virüsünün varlığı birçok testle belirlenir:
- Seroloji(aşılanmamış kişinin serum ya da beyin omurilik
sıvısındaki nötralizan antikorlar tanısaldır ancak hastalığın
genellikle sadece ileri döneminde saptanabilir).
- Cilt, beyin ya da korneal biyopsi örnekleri kullanılarak
immünofloresan antijen tayini(şekil 8). Tam kalınlıkta ense deri
biyopsisi (araştırmacının saç folikülü tabanındaki sinirlere baktığı
boynun ense cildi biyopsisi ) ya da direkt floresan antikor testi
kullanılarak kuduz antijeni için beyin biyopsisi incelenebilir.
- Tükürük, kuduz virüs RNAsı için RT-PCR (ters
transkripsiyon-polimeraz zincir reaksiyonu) ya da virüs izolasyonu
ile test edilebilir.
- Histolojik olarak Negri cisimciklerinin varlığı çok
karakteristiktir. Bunlar, enfekte insanların yaklaşık % 50-80inin
nöronlarında nükleokapsid agregatları ile oluşturulan eozinofilik
intrasitoplazmik inklüzyonlardır(Tablo 3 ve Şekil 7). Kuduz için
tipik olmakla birlikte, yanlış pozitiflikler açısından sonuçlar
kuduz konusunda deneyimli biri tarafından değerlendirilmeli ve tüm
bu sonuçlar farklı bir yöntemle teyit edilmelidir.
- Diğer testler, antijen testleri kullanılarak virüsün varlığı
belirlendikten sonra fare beyninde veya kültürde virüs üretilmesini
kapsar. Ancak anti-kuduz antikorları, sadece hastalığın çok ileri
evresinde tespit edilebilir. Polimeraz zincir reaksiyonu (PCR) da
virüsü tespit etmek için kullanılabilir (Şekil 6).
|
Tablo
4 Beyin dokusu ve
meninkslerdeki kuduz ensefalomiyelitinin (enflamasyonun) histopatolojik
kanıtı |
| Mononükleer infiltrasyon |
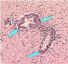 Damar çevresini saran lenfositler veya polimorf çekirdekli hücreler ya
da kan damarı etrafındaki enflamasyon
Damar çevresini saran lenfositler veya polimorf çekirdekli hücreler ya
da kan damarı etrafındaki enflamasyon
CDC |
| Lenfositik
odaklar |
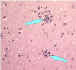 Yavru nodüller içeren glial hücreler
Yavru nodüller içeren glial hücreler
CDC |
| Negri
cisimcikleri (aşağıya bakınız) |
|
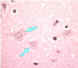 Şekil 7
Şekil 7
Negri cisimciği olmadan nöron
CDC |
 Negri cisimciği infekte nöronda
Negri cisimciği infekte nöronda
CDC
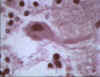 Negri cisimciği beyin hücresinde
Negri cisimciği beyin hücresinde
© Bristol Biomedical Image Archive. Used with
permission
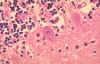 Kuduz
histopatolojisi, beyin. Karakteristik Negri cisimcikleri kuduzdan
ölen bir hasta beyinciği Purkinje hücresi içinde mevcut. Kuduz
histopatolojisi, beyin. Karakteristik Negri cisimcikleri kuduzdan
ölen bir hasta beyinciği Purkinje hücresi içinde mevcut.
CDC/Dr. Makonnen Fekadu maf1@cdc.gov
 Bir sinir hücresinde endoplazmik retikulum içine inklüzyon (Negri
cisimciği)den tomurcuklanan kuduz virusu.
Bir sinir hücresinde endoplazmik retikulum içine inklüzyon (Negri
cisimciği)den tomurcuklanan kuduz virusu.
A. Negri cisimciği.
B. Dikkat; inkluzyonda bol miktarda RNP.
C. Tomurcuklanan rabies virus.
CDC
 Ribonukleoprotein. Sarmal olan RNP bol ipliklerine dikkat edin (resimde
hemen her şey RNP'dir).
Ribonukleoprotein. Sarmal olan RNP bol ipliklerine dikkat edin (resimde
hemen her şey RNP'dir).
CDC
|
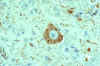 İntrasitoplazmik inklüzyonlar (Negri cisimcikleri) ile kuduz virüs
bulaşmış nöronal hücre . Kırmızı boyama IHK veya avidin-biotin kompleksi
ile kuduz viral antijenin alanlarını göstermektedir
İntrasitoplazmik inklüzyonlar (Negri cisimcikleri) ile kuduz virüs
bulaşmış nöronal hücre . Kırmızı boyama IHK veya avidin-biotin kompleksi
ile kuduz viral antijenin alanlarını göstermektedir
CDC |

 Şekil 8
Şekil 8
Direkt floresan antikor testi (DFA)
DFA kuduz virüsü ile enfekte bir hayvan dokusunda mevcut kuduz virüsü
proteini (antijen) sahip olacağı prensibine dayanır. Kuduz sinir
dokusunda (ve diğer virüsler gibi kanda olmayan) mevcut olduğu için,
kuduz antigenin mevcudiyetini test etmek için ideal doku beyindir. Bir
DFA testinin en önemli parçası floresan işaretli anti-kuduz antikordur.
Etiketlenmiş antikor kuduz şüpheli beyin dokusuna ilave edildiğinde,
kuduz antijeni mevcut ise buna bağlanacaktır. Bağlanmamış antikor
yıkanarak uzaklaştırılır ve bir floresan mikroskop ile bakıldığında
antijen antikor bağlı olan alanlar parlak floresan yeşil renk olarak
görünürKuduz virusu yoksa herhangi bir boyama olmayacaktır. DFA testinde
kuduz antikoru öncelikle virusun nükleoproteinine yöneliktir. Kuduz
virusu hücrelerin sitoplazmasında çoğalır, ve enfekte hücreler, DFA
prosedürü ile boyanmış ise toz benzeri floresan parçacıklar olarak
görünen büyük yuvarlak veya nükleoproteine (N) veya antijen küçük
koleksiyonlarını içeren oval inklüzyonlar içerebilir
CDC
|
MARUZİYET OLASILIĞI OLAN KİŞİNİN KORUNMASI VE
TEDAVİSİ
Yara, hemen ve iyice sabun ve su
ile yıkanmalı, ardından% 40-70lik etil alkol ya da benzil amonyum klorür gibi
bir antiseptik ile müdahale edilmelidir. Devlet Sağlık yetkilileri, gecikmeden
bilgilendirilmelidir. Sağlık Bakanlığına kuduza maruziyet riski olup olmadığı
konusunda danışılarak profilaktik tedavi verilmelidir. Hayvana ulaşılabiliyorsa,
beyin kuduz virüsü antijeni için floresan antikor ile tetkik edilmelidir. (Bazı
durumlarda, ısırık bir evcil bir kedi ya da köpek tarafından gerçekleştirildiyse
hayvan yakın gözlem altında tutulabilir).
Maruziyet sonrası profilaksi
Kuduz aşısı
İnaktive edilmiş bir aşıdır
ve kuvvetli immünojeniktir. İnsan diploid hücrelerinde veya rhesus
maymunu akciğer hücrelerinde üretilir ve 1980'lerin başında kullanılan
aşıdan daha güçlüdür ve daha az yan etkiye sahiptir. Saflaştırılmış
civciv embriyo hücresinden üretilen bir aşı da mevcuttur. Aşı, 4
haftalık bir süre boyunca bir dizi enjeksiyon halinde uygulanmaktadır.
HRIG (insan kuduz immünglobulin) de ayrıca verilmektedir.
İnsan kuduz immünglobulini (HRIG)
HRIG hiperimmün donörlerin
plazmasından hazırlanır. Önerilen dozun yaklaşık yarısı mümkünse yara
alanı içine verilmelidir. Geri kalanı kas içi enjeksiyonu olarak verilir.
HRIG ve aşı için farklı şırınga ve farklı bir alan kullanılır, böylece
HRIG aşıyı nötralize etmez.
Şimdiye kadar ABDde,
maruziyet sonrası uygun profilaksi alıp kuduz gelişen hiçbir vaka
olmamıştır. (ABD'de yılda yaklaşık 40.000 kişi tedavi edilmektedir).
Maruziyet öncesi profilaksi
Kuduz enfeksiyonu riski taşıyan
insanlar bir önleyici tedbir olarak aşılanabilir. Bu tür bireyler arasında:
-
Kuduz-laboratuvarı
çalışanları
-
Kuduzun enzootik olduğu
bölgelerde kuduz hayvanlara maruz kalma riski olan belirli kişiler:
veterinerler ve ekipleri, yaban hayatı kontrol çalışanları, mağara
araştırmacıları (çoğunlukla bu mağara kaşifleri yarasa kolonileri olan
gelişmemiş mağaralara girerler); kuduzun enzootik olduğu alanlarda bir
aydan fazla kalacak olan gezginler bulunur.
Kuduz hayvanlara maruz kalma
riski yüksek kişiler düzenli serolojik olarak test edilmeli ve gerektiğinde
yükleme dozunda aşı olmalıdır.
Aşılanmış bir kişi kuduza maruz
kalırsa, yine de temas sonrası profilaksi almalıdır, ancak maruziyet sonrası
yapılan aşı sayısı azaltılır ve HRIG kullanılmaz.
Tedavi
Semptomlar ısırık alanında
lokalize kalırsa, agresif antiviral tedavi (aşı, HRIG, ribavirin,
interferon, monoklonal antikorlar, vb) denenebilir. MSS belirtileri
geliştiğinde özel bir anti-viral tedavi yoktur. Yoğun destekleyici bakım
verilir. Kuduz enfeksiyonundan kurtulduğu bilinen altı olgunun beşi klinik
semptomlar gelişmeden profilaksi almıştır. Aşılanmadan kuduzdan kurtulan
birkaç kanıtlanmış vaka olmuştur. (Soldaki olgu raporuna ve aşağıdaki
bölümüne bakınız).
2009 yılında, Teksas'ta bir
ergen kızda hastalanmadan 2 ay önce maruz kaldığı yarasalar neticesinde
ensefalit gelişmiştir. Anti-kuduz virüsü antikorları indirekt floresan
antikor testi kullanılarak serum ve beyin-omurilik sıvısında tespit
edilmiştir. Ancak, kuduz virüsü nötralizan antikorların varlığı tek doz
kuduz aşısı ve kuduz insan immün globulini alımı sonrasına kadar tespit
edilmemiştir. Çoklu yatışlara ve tekrarlayan nörolojik semptomlar için
kontrol vizitlere ihtiyaç duyulsa da yoğun bakım gereği olmadan kurtulmuştur.
İndüklenen Koma ile kuduz tedavisi
Milwaukee Protokolü
Kuduz ile enfekte hastanın maruziyet sonrası nörolojik semptomlar
gelişmeden önce hızlı tedavisi genellikle başarılı olur. Bu semptomlar
gelişince geçici beyin disfonksiyonu sonucu hastalık ölümcül kabul
edilir.
Şimdiye kadar kuduzla
enfekte olup semptomların başlamasından önce maruziyet sonrası aşılama
yapılmadan hayatta kalmış bilinen altı kişi vardır. Bu bireyleri tedavi
etmek için kullanılan prosedür, hasta kimyasalla başlatılan komadayken
anti-viral ilaçlar verilmesini içerir. Bu Wisconsin protokolü,
Willoughby protokolü veya en sık olarak da, Milwaukee protokolü şekilde
de anılan protokol, ilk defa Wisconsinli bir genç olan Jeanna Giese
üzerinde Dr. Rodney Willoughby tarafından uygulanmıştır. CDCden alınan
bu ve diğer olgularla ilgili detaylar soldaki linkte verilmektedir.
Amerika Birleşik
Devletleri'ndeki çoğu vakada olduğu gibi, bayan Giese de kuduz bir
yarasa tarafından enfekte edilmiş ve enfeksiyon yarasa ısırması ile
bulaşmıştır. Isırık hidrojen peroksit ile muamele edilmiş ancak aile
daha sonra enfeksiyon potansiyelini gözardı etmiştir. Hastada
sonradan(yaklaşık beş hafta), kolda sıçrama, konuşma bozukluğu ve
diplopiyi (çift görme) içeren nörolojik semptomlar ve ateş gelişmesi ile
kuduz tanısı konulmuştur. Hiçbir canlı virüs izole edilmemiş ancak anti-kuduz
antikorları yükselmiştir.
Milwaukee protokolü,
hastanın anti-viral nötralizan antikorların gelişmesine yetecek kadar
uzun bir süre için komada tutulmasını (beyni korumak için) içerir. Koma
genel anestezide kullanılan bir ilaç olan ketamin ve bir benzodiazepin
sedatif olan midazolam ile oluşturulur. Buna ek olarak, hastaya iki
anti-viral ilaç: ribavirin ve amantadin uygulanır. Protokolün revize
edilmiş versiyonunda, ribavirin kullanılmaz. Virüsü yenmek için belirgin
bir immün yanıt oluşana kadar hasta komada tutulur. Bayan Giesede
virüse bağlı beyin hasarı sonucunda bazı nörolojik semptomlar oluşmuş ve
daha ileri tedaviye ihtiyaç duyulmuştur.
 Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
This page last changed on
Tuesday, November 22, 2016
Page maintained by
Richard Hunt
|
|
VAKA RAPORLARI
Klinik kuduzdan bir hastanın iyileşmesi--- Wisconsin, 2004
Organ
Bağış ve Nakil Alıcılarında Kuduz Enfeksiyonlarının Araştırılması
Muhtemel
Abortif İnsan Kuduzu --- Texas, 2009
Klinik
kuduzdan bir hastanın iyileşmesi California, 2011
|
|
|

 Şekil 1A
Şekil 1A 
 Şekil 6
Şekil 6 Şekil 7
Şekil 7  İntrasitoplazmik inklüzyonlar (Negri cisimcikleri) ile kuduz virüs
bulaşmış nöronal hücre . Kırmızı boyama IHK veya avidin-biotin kompleksi
ile kuduz viral antijenin alanlarını göstermektedir
İntrasitoplazmik inklüzyonlar (Negri cisimcikleri) ile kuduz virüs
bulaşmış nöronal hücre . Kırmızı boyama IHK veya avidin-biotin kompleksi
ile kuduz viral antijenin alanlarını göstermektedir 
 Şekil 8
Şekil 8 


 CDC
CDC