|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
|
İMMÜNOLOJİ BÖLÜM BİR
DOĞAL (ÖZGÜL OLMAYAN / NON-SPESİFİK) İMMÜNİTE (BAĞIŞIKLIK)
Gene Mayer, Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Erkan Yula, Doç. Dr.
İzmir, Katip Çelebi Üniversitesi Tıp Fakültesi Mikrobiyoloji Anabilim Dalı
|
|
ENGLISH |
|
FRANCAIS |
|
ESPANOL |
|
PORTUGUES |
|
SHQIP |
|
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|
 |
|
Logo image
© Jeffrey Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
ÖĞRENİM HEDEFLERİ
Enfeksiyon ve hastalıklarla mücadelede immün sistemin öneminin
anlaşılması
Özgül olmayan (Doğal) ve özgül (adaptif) immün sistemin ayırt edilmesi
Enfeksiyon/hastalık durumlarında direnç mekanizmalarının anlaşılması
Özgül olmayan immün sistemin humoral ve hücresel bileşenlerinin
bilinmesi
Özgül olmayan immün sistemin humoral ve hücresel komponentlerinin
mekanizmalarının anlaşılması
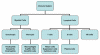
 Şekil 1
Şekil 1
İmmün sisteme genel bakış
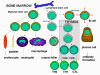
 Şekil 2
Şekil 2
İmmün sistemin hücreleri
 Şekil 3
Şekil 3
İmmün sistem hücrelerinin gelişimi
|
BAĞIŞIKLIK SİSTEMİNE GENEL
BAKIŞ
Organizma sürekli olarak enfeksiyöz etkenlere maruz
kalmaktadır ve çoğu durumda enfeksiyonlara karşı direnç
gösterebilmektedir. Bu enfeksiyonlara karşı gösterilen direnci sağlayan
ise kişinin immün (bağışıklık) sistemidir. Bağışıklık sistemi iki ana
alt bölümden oluşmaktadır, doğal ya da özgül olmayan (non-spesifik)
bağışıklık sistemi ve kazanılmış/adaptif veya özgül (spesifik)
bağışıklık sistemi (Şekil 1). Doğal immün sistem, istilacı organizmalara
karşı ilk savunma hattını oluştururken kazanılmış immün sistem ikinci
savunma hattı olarak rol oynamaktadır ve ayrıca aynı patojene tekrar
maruziyete karşı koruma sağlamaktadır. İmmün sistemin heriki majör alt
birimi de koruyucu fonksiyonları yürüten hücresel ve humoral
komponentlere sahiptir (Şekil 1). Buna ek olarak, doğal bağışıklık
sistemi, enfeksiyonlara karşı bariyerler olarak işlev gören anatomik
özelliklere sahiptir. Bağışıklık sisteminin bu iki kolu ayrı
fonksiyonlara sahip olmasına rağmen bu sistemler arasındaki sıkı bir
etkileşim bulunmaktadır (örneğin, doğal bağışıklık sisteminin
bileşenleri kazanılmış bağışıklık sistemi etkilemektedir veya tam tersi).
Hernekadar doğal ve adaptif bağışıklık sisteminin her
ikisininde görevleri istilacı organizmalara karşı korumak olsa da birçok
farklılıklara sahiptirler. Kazanılmış bağışıklık sistemi istilacı
organizmaya karşı reaksiyon gösterebilmek için zamana ihtiyaç
duymaktadır oysa doğal immün sistem, çoğunlukla yapısal olarak
enfeksiyona karşı harekete geçimek için hazır durumdadır. İkinci olarak
adaptif immün sistem, antijene spesifiktir ve sadece immün yanıtı
idükleyen organizma ile reaksiyona girer. Buna karşılık, doğal
bağışıklık sistemi, antijene spesifik değildir ve çeşitli organizmalar
için eşit derecede iyi bir tepki verir. Son olarak, adaptif bağışıklık
sistemi immünolojik bir belleğe sahiptir. Bu mekanizma invaze eden bir
organizma ile tekrar karşılaştığını hatırlar ve aynı organizma ile
sonraki karşılaşmalarda daha hızlı bir reaksiyon geliştirir. Buna zıt
olarak doğal immün sistemin ise immünolojik hafızası yoktur.
İmmün sistem hücrelerinin hepsinin kökeni kemik iliğidir
ve myeloid (nötrofil, bazofil, eozinofil, makrofaj ve dendritik hücreler)
ve lenfoid hüclerden (B lenfosit, T lenfosit ve Natural Killer/Doğal
katil hücreler) oluşmaktadır (Şekil 2) ve bu hücre serileri ayrı
yolaklarda farklılaşmaktadır (Şekil 3). Myloid öncül (kök) hücrelerden
eritrosit, trombosit, nötrofil, monosit/makrofaj ve dentritik hücreler
oluşurken lenfoid öncül (kök) hücrelerden NK, T lenfositler ve B
lenfositler oluşmaktadır. T hücre gelişimi için öncül T hücrelerin iki
ayrı hücre tipine (CD4+ T helper hücre ve CD8+ pre-sitotoksik T hücre)
farklılaştıkları timusa göç etmeleri gerekmektedir. Timusda iki çeşit
yardımcı T hücresi (T helper) üretilmektedir, TH1 ve TH2. TH1 hücreler
CD8+ pre-sitotoksik hücrelerin sitotoksik T hücrelerine farklılaşmasına
yardım ederken, TH2 hücreler, B lenfositlerin antikor sekrete eden
plazma hücrelerine farklılaşmasına yardım eder.
Bağışıklık sisteminin ana işlevi kendinden ve kendinden
olmayanı (self/non-self) ayırt edebilmesidir. Kendinden olan ile
olmayanı ayırt edebilme yeteneği istilacı organizmalardan korunmak için
ve değişime uğramış hücrelerin (örneğin malign hücreler) eleminasyonu
için gereklidir. Patojenlerin intrasellüler (virüsler ve bazı bakteri ve
parazitler) veya ekstrasellüler (çoğu bakteri, mantar ve parazitler)
çoğalmaları nedeniyle immün sistemin farklı bileşenleri patojenlerin bu
farklı türlerine karşı korumak için gelişmiştir. Bir organizma ile
enfekte olmanın mutlaka hastalık gelişeceği analamına gelmediğini ve
immün sistemin çoğu durumda enfeksiyonu hastalık meydana gelmeden önce
elemine edebileceğini akılda tutmak önemlidir. Enfeksiyöz hastalıklar
genellikle istilacı organizmanın virulansının yüksek ve bolus tarzında
yoğun bir enfeksiyon varlığında veya bağışıklık sistemi sorunlarında
meydana gelmektedir. Hernekadar bağışıklık sistemi genel olarak faydalı
etkilere sahip olsada bazı durumlarda zararlı etkileri de olabilmektedir.
İstilacı mikroorganizmaya karşı gelişen enflamasyon süresince lokal
rahatsızlık hissi ve immün tepki olarak üretilen toksik ürünlerin sonucu
olarak sağlıklı dokularda hasar oluşabilmektedir. Ek olarak bazı
durumlarda otoimmün hastalıklarla sonuçlanacak şekilde immün yanıt,
kendi dokularına karşı yönlendirilebilmektedir.
|
Tablo 1 |
|
Non-spesifik İmmünite (Doğal Bağışıklık) |
Adapatif/Kazanılmış (Özgül İmmünite) |
| Yanıt
antijen-bağımsız |
Yanıt
antijen-bağımlı |
|
Hızlı maksimal yanıt var |
Etkene maruziyet ile maksimal yanıt arasında bir gecikme süresi (lag time)
vardır |
|
Antijen-spesifik değil |
Antigen-spesifik |
|
Etkene maruziyet herhangi bir immünolojik bellekle
sonuçlanmaz |
Etkene maruziyet bir immünolojik bellekle
sonuçlanır
|
|
| |
DOĞAL (NON-SPESİFİK)
İMMÜNİTE
Doğal (spesifik olmayan) bağışıklık sisteminin bileşenleri (Tablo
2), anatomik engelleri, salgısal molekülleri ve hücresel yapıları içermektedir.
Mekanik anatomik engellerin arasında deri ve internal epitel tabakaları,
bağırsak hareketi ve bronkopulmoner siliaların salınım hareketi vardır. Bu
koruyucu yüzeyler, çeşitli kimyasal ve biyolojik maddeler ile ilişkilidir.
Enfeksiyonlara karşı
Anatomik engeller
Epitelyal yüzeyler, yüksek derecede enfeksiyöz etkenlere
karşı bile aşılması zor bir fiziksel bariyer oluşturur. Böylece deri,
istilacı organizmalara karşı birinci basamak defans hattı olarak rol
oynar. Deri epitel hücrelerinin deskuamasyonu da epitel yüzeyine yapışan
bakteri ve diğer bulaşıcı etkenlerden temizlenmesine yardımcı olur. Yine
benzer şekilde solunum sistemindeki silianın hareketi veya intestinal
peristaltizm hava yollarının ve gastrointestinal sistemin
mikroorganizmaları uzaklaştırmasına yardımcı olmaktadır. Gözyaşı ve
salivanın yıkayıcı eylemi oküler ve oral enfeksiyonları önlemeye
yardımcı olmaktadır. Solunum ve gastrointestinal sistemdeki mukusun
partikülleri yakalayıcı etkisi solunum ve sindirim yolu
enfeksiyonularını önlemeye yardım etmektedir.
Kimysal faktörler
Terde bulunan yağ asitleri bakterilerin çoğalmasını
inhibe etmektedir. Ter, oral ve nazal sekresyonlarda bulunan lizozim ve
fosfolipaz, bakteri hücre duvarını yıkabilir ve bakteriyel membranların
stabilitesi bozabilirler. Ter ve gastrik sekresyonların düşük pHsı
bakteriyel çoğalmayı engellemektedir. Akciğerlerde ve gastrointestinal
kanalda bulunan defensinlerin (düşük moleküler ağırlıklı proteinler)
antimikrobiyal aktivitesi bulunmaktadır. Ter, aynı zamanda düşük molekül
ağırlıklı anti-mikrobiyal peptitler içerir. Bu peptitler bakteriyel
hücre zarı ile (MRSA dahil) etkileşime girer ve su ve iyon geçişini
sağlayan bir kanal meydana getirir, membran potansiyeli bozar ve
hücrenin ölümüne yol açar. Akciğerlerde bulunan sürfaktanlar opsonin
olarak davranmaktadır (Opsonin: partiküllerin fagositik hücreler
tarafından fagositozunu kolaylaştıran maddelerdir).
Biyolojik faktörler
Derideki ve gastrointestinal kanaldaki normal flora
üyeleri, toksik maddeler sekrete ederek veya patojenik bakteriler ile
besin ve hücre yüzeyine bağlanmak için yarışarak patojenik bakterilerin
kolonize olmasına karşı koruma sağlarlar.
Enfeksiyona karşı
humoral (salgısal) engeller
Anotomik bariyerler dokuların mikroorganizmalar tarafından
kolonizasyonuna karşı korunmasında oldukça etkilidirler. Fakat, dokularda
bir zedelenme olduğunda anatomik engeller kolaylıkla aşılabilir ve
enfeksiyon oluşabilir. Enfeksiyöz etkenler, dokulara penetre olduklarında
akut enflamasyon olarak adlandırılan diğer bir doğal defans mekanizması
devreye girer. Enflamasyonda, humoral faktörler fagositotik hücrelerin
takviyesinde ve ödem oluşumunda oldukça önemli rollare sahiptir.
Kompleman sistemi
Kompleman sistemi major hümoral özgül olmayan defans mekanizmasıdır (kompleman
bölümüne bakınız). Kompleman aktive olduğunda vasküler permiabiletenin
artışına, fagositotik hücrelerin güçlenmesine ve bakterinin
opsonizasyonuna ve lizisine yol açabilmektedir.
Koagülasyon sistemi
Doku zedelenmesinin şiddetine bağlı olarak, koagülasyon sistemi
aktifleştirilebilir veya aktifleştirilmeyebilir. Koagülasyon sisteminin
bazı ürünleri, fagositotik hücreler için kemotaktik madde olarak
davranarak ve vasküler permiabiletyi artırarak özgül olmayan immün
sisteme katılmaktadırlar. Ek olarak koagülasyon sisteminin bazı ürünleri
direkt olarak antimikrobiyal etki göstermektedirler. Örneğin plateler
tarafından koagüülasyon sürecinde üretilen protein yapısındaki beta-lizin,
birçok Gram pozitif bakteriyi katyonik deterjan olarak etki ederek
parçalayabilirler.
Laktoferrin ve transferin
Bakteriler için esansiyel bir besin içeriği olan demiri bağlayarak
baktertiyel büyümeyi sınırlandırılar.
İnterferonlar
Hücre içerisindeki virüs replkasyonunu sınırlandıran protein yapısındaki
moleküllerdir.
Lizozim
Lizozim bakteri hücre duvarını yıkmaktadır.
İnterlökin-1
IL-1 ateşi artırarak ve bakteriyi opsonize ederek antimikrobiyal özellik
sergileyen bazı akut faz reaktanlarının üretimini indüklemektedir.
|
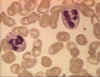 Şekil 4A
Şekil 4A
Kan yaymasında iki nötrofil © Bristol Biomedical Image Archive Used with
permission
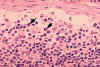 Şekil 4B HIV-1 enfeksiyonu nedneniyle oluşan lenfadenopati
histopatolojisi. Subkapsüler sinüs. Sinüs, artmış sayıda nötrofil
içermektedir. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
Şekil 4B HIV-1 enfeksiyonu nedneniyle oluşan lenfadenopati
histopatolojisi. Subkapsüler sinüs. Sinüs, artmış sayıda nötrofil
içermektedir. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
 Şekil 4C
Şekil 4C
Nötrofil - elektron mikrografi. İki nükleer loba ve
azurofilik granüle dikkat ediniz.© Dr Louise Odor, University of South
Carolina School of Medicine
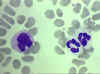 Şekil 4D
Şekil 4D
Kan yayması monosit (solda) ve iki nötrofili
görülmektedir. © Bristol Biomedical Image Archive Used with permission |
|
Table 2. Enfeksiyonlara karşı fiziksel ve kimysal
engeller |
|
Sistem/Organ |
Aktif öğe |
Efektör Mekanizma |
|
Deri |
Skuamoz hücreler; Ter |
Deskuamasyon; yıkayıcı etki, organik asitler |
|
Gastro intestinal kanal |
Kolumnar hücreler |
Peristaltizm, düşük pH, safra asitleri, yıkayıcı etki, tiosianat |
|
Akciğer |
Trakeal silia |
Mukosiliar uzaklaştırma, sürfaktan |
|
Nazofarink ve göz |
Mukus, tükürük, gözyaşı |
Yıkayıcı etki, lizozim |
|
Kan dolaşımı ve lenfoid organlar |
Fagositik hücreler
NK hücreler ve K-hücre
LAK
|
Fagositoz ve intrasellüler öldürme
Direkt and antikor bağımlı sitoliz
IL2-aktive sitoliz |
|
Serum |
Laktoferrin ve Transferrin |
Demirin bağlanması |
|
İnterferon |
Antiviral proteinler |
| TNF-alfa |
Antiviral, fagosit aktivasyonu |
|
Lizozim |
Peptidoglikan hidrolizisi |
|
Fibronektin |
Opsonizasyon ve fagositozis |
|
Kompleman |
Opsonizasyon, güçlendirilmiş
fagositoz, inflamasyon |
|
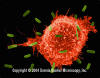 Şekil 5
Şekil 5
E.coliye saldıran makrofaj (SEM x8,800) © Dr Dennis Kunkel
(used with permission)
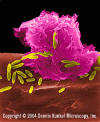 Şekil 6
Şekil 6
E. coliye saldıran alveolar (akciğer) (SEM x10,000) © Dr
Dennis Kunkel (used with permission)
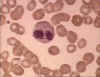 Şekil 6A
Şekil 6A
İnce yaymada eozinofil. Bristol Biomedical Image Archive Used with
permission
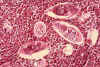 Şekil 6B
Şekil 6B
Mesanenin histopatolojik incelemesinde Schistosoma
haematobium yumurtaları, yoğun eozinofil infiltrasyonu ile çevrelenmiş halde
CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
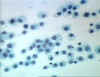 Şekil 7
Şekil 7
Histiositler Doku içinde uzun ömürlü dirençli makrofajlar.
© Bristol Biomedical Image Archive Used with permission
 Şekil 8
Malaria parazitini sindirmiş monosit.
CDC/Dr. Melvin
Şekil 8
Malaria parazitini sindirmiş monosit.
CDC/Dr. Melvin
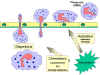 Şekil
9 İnflamatuvar uyarıya kemotaktik cevap Şekil
9 İnflamatuvar uyarıya kemotaktik cevap |
Enfeksiyona karşı hücresel engeller
Enflamatuvar cevap, polimorfonükleer eozinofill ve makrofajların
enfenksiyon bölgesine takviyesidir. Bu hücreler özgül olmayan immün sistemin
ana savunma hattını oluştururlar.
Nötrofiller
Polimorfonükleer hücreler (PMN, Şekil 4) istilacı organizmanın fagosite
edildiği ve hücre içi öldürüldüğü enfeksiyon bölgesine çekilirler.
Bunula birlikte, PMNler enflamasyon süresince gerçekleşen yakın
dokulardaki hasara da katkıda bulunmaktadırlar.
Makrofajlar
Doku makraajları (Şekil 5, 6 ve 7) ve yeni toplanmış monositler (Şekil 4
ve 8) ki bunlar makrofaja farklılaşacaklardır, aynı zamanda
mikroorganizmanın hücreiçi öldürülmesinde ve fagositozunda da görev
görürler. Buna ek olarak makrofajlar enfekte veya değişime uğramış kendi
hücrelerin ekstrasellüler öldürme kapasitesine de sahiptirler. Dahası,
makrofajlar, dokunun iyileşmesine katkıda bulunurlar ve özgül immün
sistemin uyarılması için gerekli olan antijen sunan hücreler olarak
görev görürler.
Doğal katil (NK) ve lenfokinle aktive katil
(LAK) hücreler
NK ve LAK hücreler virüsler enfekte hücreyi ve tümör hücrelerini non-spesifik
olarak öldürebilirler. Bu hücreler enflamatuvar cevabın bir bir parçası
değillerdir fakat viral enfeksiyonlara ve tümörün gözaltında tutulması
açısından özgül olmayan immünitede önemlidirler.
Eozinofiller
Eozinofiller (Şekil 6a ve b) granüllerinde protein yapısında moleküllere
sahiptir ve bazı parazitlerin öldürülmesinde etkilidirler.
FAGOSİTOZ VE HÜCRE İÇİ ÖLDÜRME
Fagositik Hücreler
Nötrofiller/Polimorfonükleer hücreler
PMN hücreler, loblu çekirdeğe sahip haraketli fagositik hücrelerdir.
Karakteristik çekirdekleri veya hücre yüzeyinde CD66 olarak adlandırılan
antijen valığı ile tanımlanabilirler. Bu hücreler, antimikrobiyal
özellikte iki çeşit granüle sahiptirler. Primer veya azurofilik
granüller: katyonik protein ve defensin içeren ve genç yeni oluşan PMN
hücrede bol olarak bulunan granüllerdir ve bakterileri öldürürler,
elastaz benzeri proteolitik enzimleri ve proteinleri paraçalayan
katepsin G, hücre duvarını yıkan lizozim ve tipik olarak bakteriyosidal
bileşiklerin üretiminde yer alan myeloperoksidaz içeriğine sahiptir.
İkinci tip granül ise olgun PMN hücrelerde daha fazla bulunan sekonder
veya spesifik ganüllerdir. Bu granüller lizozim, toksik oksijen
ürünlerinin üretiminde yer alan NADPH oksidaz bileşenleri ve
karakteristik olarak demir şelatlayıcı protein olan laktoferrin ve B12
bağlayan protein içerirler.
Monositler/Makrofajlar
Makrofajlar tipik olarak böbrek şeklindeki çekirdeği olan fagositotik
hücrelerdir. Morfolojik olarak veya hücre yüzey belirteci olarak CD14
varlığı ile kimlikledirilirler. PMN hücrelerden farklı olark granül
içermezler fakat PMN granüllerine benzer içeriğe sahip çok sayıda
lizozomlara sahiptirler.
Fagositlerin enfeksiyona yanıtı
Dolaşımdaki PMNler ve mositler enfeksiyon bölgesinde üretilen tehlike
(SOS) sinyallerine yanıt oluşturmaktadırlar. SOS sinyalleri bakteri
tarafında salınan N-formil-metionin içeren peptiler, koagülasyon sistemi
peptitleri, kompleman ürünleri ve doku makrofajlkarı tarafından bakteri ile
karşılaştıklarında salınan sitokinleri içermektedir. Bazı SOS sinyalleri
enfeksiyon yakınındaki hücrelerin ICAM-1 ve selektin gibi fagositik hücrenin
yüzeyine komponentlerin bağlanmasına yol açan adhezyon moleküllerin
ekspresyonunu tetikler ve fagositlerin endotele yapışmasına neden olur.
Enfeksiyon bölgesinde üretilen vazodilatörler endotelyal hücreler arası
kavşakların gevşemesine yol açar ve sonrasında fagositler endotelyal
bariyeri sızarak aşarlar ve bu işlem diapedezis olarak adlandırılmaktadır
(Şekil 9). Doku boşluklarında bazı SOS sinyalleri fagositleri enfeksiyon
alanına kemotaksis (artan kimyasal gradiente doğru hareket) ile çekerler.
SOS sinyalleri aynı zamanda fagositleri fagositozun artışını ve istilacı
organizmanın intrasellüler öldürülmesini aktive ederler.
|
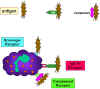 Şekil 10
Bakterinin reseptörler vasıtasıyla tutulması
Şekil 10
Bakterinin reseptörler vasıtasıyla tutulması |
Fagositozun başlaması (Şekil
10)
Fagositik hücrelerin hücre zarlarının üzerinde çok çeşitli reseptör
türleri bulunmaktadır bunlar vasıtasi ile farklıenfeksiyöz etkenler
bağlanabilirler. Bu reseptörler:
Fc reseptörleri
IgG antikoru ile kaplı bakteri yüzeylerinde immünglobülünün Fc
parçası dışa bakacak şekilde açığa çıkmakta ve molekülün bu kısmı
ile fagositin reseptörüne bağlanabilmektedir. Fc reseptörüne
bağlanabilmesi için önceden antijen-antikor etkileşimi olmasına
ihtiyaç duyulmaktadır. IgG kaplı bakterinin Fc reseptörlerine
bağlanması fagositozun güçlenmesi ve fagositlerin metabolik
aktivitelelerinin aktive olmasına (solunum patlaması) yol açmaktadır.
Kompleman reseptörleri
Fagositik hücreler komplemanın 3. komponenti (C3b) için reseptör
barındırmaktadır. C3b kaplı bakterinin bu resptöre bağlanması da
fagositozun güçlenmesi ve solunum patlamasının uyarılması ile
sonuçlanmaktadır.Çöpçü (scavenger)
reseptörler
Çöpçü reseptörler, bakteri yüzeylerindeki çok çeşitli polianyonlara
bağlanarak bakterinin fagosite edilmesine yol açarlar.
Toll-like reseptörler
Fagositik hücreler çok çeşitli Toll-like reseptürlere (Pattern
Recognition Receptors veya PRRs) sahiptirler. Bu reseptörler
enfeksiyöz etkenin üzerinde PAMPs (pathogen associated molecular
patterns-patojen ilişkili moleküler kalıplar) olarak adlandırılan
çok çeşitli moleküler kalıpları tanıyabilmektedirler. Enfeksiyöz
etkenin Toll-like reseptörler vasıtasıyla bağlanması fagositozizsle
ve fagositlerden inflamatuvar sitokinlerin(IL-1, TNF-alfa ve IL-6)
salınması ile sonuçlanmaktadır.
|
| |
Fagositozis
Bakterinin bağlanmasından sonra fagosit bakteri etrafına pseudopodlarını
uzatmaya başlar. Nihayetinde pseudopodlar bakteriyi kuşatır ve içine doğru
çekerek yutar ve bakteri bir fagozom içinde çevrelenir. Fagositoz süresince
fagositin granülleri veya lizozomları fagazom ile füzyonu gerçekleşir ve
içeriklerini boşaltırlar. Sonuç bir ganüllerin veya lizozomların içeriğini
ihtiva eden fagolizozom içinde yutulmuş bir bakteridir.
|
|
|
|
Video
Nötrofil kemotaksisi
Low Resolution (Quicktime)
High Resolution (Quicktime)
© Mondo Media, San Francisco, Calif., USA
and
The
MicrobeLibrary
|
Video
Fagositozis
Quicktime
© James A. Sullivan, CellsAlive! Video, Charlottesville, Va., USA
and The
MicrobeLibrary
Video
Fagositozis ve bakteriyel patojenler
Interaktif Flash
© Thomas M. Terry
University of Connecticut
Storrs, CT 06269 USA
and The MicrobeLibrary |
|
 Şekil11
Şekil11
A. Solunum patlaması: Oksijen-bağımlı, myeloperoksidaz-
bağımsız reaksiyonlar
 B. Solunum patlaması: Oksijen-bağımlı, myeloperoksidaz-
bağımlı reaksiyonlar
B. Solunum patlaması: Oksijen-bağımlı, myeloperoksidaz-
bağımlı reaksiyonlar |
Solunum patlaması
ve hücreiçi öldürme
Fagositoz süresince glukoz ve oksijen tüketiminde artış
oluşmaktadır ve bu durum solunum patlaması olarak adlandırılmaktadır.
Solunum patlamasının sonucunda fagosite edilmiş bakteriyi öldürecek birçok
oksijen içeren bileşikler üretilmektedir. Bu durum oksijen bağımlı hücre içi
öldürme olarak adlandırılmaktadır. Ek olarak bakteri granüller ve lizozom
kaynaklı daha önceden üretilmiş litik moleküller ile de öldürülmektedir. Bu
durum ise oksijenden bağımsız hücre içi öldürme olarak adlandırılmaktadır.
Oksijen bağımlı
miyeloperoksidaz-bağımsız hücre içi öldürme (Şekil 11A)
Fagositoz süresince glikoz, pentoz monofosfat yolağı ile metabolize
edilmektedir ve NADPH oluşmaktadır. Spesifik granülün bir parçası olan
Sitokrom B plazma membranındaki NADPH oksidaz ile birleştirir ve aktive
eder. Aktive olan NADPH oksidaz, NADPHın oksidasyonu için oksijen
kullanmaktadır. Sonuçta süperoksit anyonu üretimi gerçekleşmektedir. Bir
kısım süperoksit anyonu süperoksit dismutaz tarafından H2O2
ve tekli oksijene (1O2) dönüştürülür. Ek olarak süperoksit
anyonu H2O2 ile reaksiyona girebilir ve hidroksi
radikalleri ve daha fazla tekli oksijen (1O2) oluşumuna yol
açabilirler. Bütün bu reaksiyonların sonucunda toksik oksijen
bileşiklerinin süperoksit anyonu, H2O2, tekli
oksijen(1O2) ve hidroksi radikali (OH) üretimi
gerçekleşmektedir.
Oksijen ve miyoloperoksidaz bağımlı hücre içi
öldürme (Şekil 11B)
Azurofilik granüllerin fagozom ile füzyonu ile fagolizozom içerisine
myloperoksidaz salınır. Miyoloperoksidaz yüksek derecede toksik olan
hipoklorit üretimi için H2O2 ve halojen içeren iyonları (sıklıkla Cl-)
kullanmaktadır. Bazı hipoklorit molekülleri tekli oksijen üretmek üzere
spontan olarak parçalanırlar Bu reaksiyonların sonucunda toksik
hipoklorit (OCl-) ve tekli oksijen (1O2) üretimi
gerçekleşmektedir.
Detoksifikasyon reaksiyonları (Tablo
3)
PMN lökositler ve makrofajlar toksik oksijen aracılarından kendilerini
korumak istemektedirler. Bu reaksiyonlar süperoksit dismutaz enzimi ile
süperoksit anyonunun hidrojen perokside dismutasyonu ve katalaz enzimi
vasıtası ile de hidrojen peroksidin suya dönüştürülmesidir.
|
Tablo 3 |
|
Reaksiyon |
Enzim |
| H2O2 + Cl-
--> OCl- + H2O |
Myeloperoksidaz |
| OCl- + H2O
--> 1O2
+Cl- + H2O |
| 2O2 + 2H+
--> O2-
+ H2O2 |
Superoksid dismutaz |
| H2O2 --> H2O + O2 |
Katalaz |
Oksijenden bağımsız hücre içi
öldürme (Tablo 4)
Fagositlerde oksijen bağımlı öldürme mekanizmalarına ek olarak oksijen
bağımsız mekanizmalar da bulunmaktadır: katyonik proteinler (katepsin)
fagolizozom içerisine salınarak bakteriyel membran hasarı oluşturulması;
lizozimin hücre duvarını yıkması; laktoferrin bakteri için gerekli
nütrisyonel bir destek olan demirle şelat oluşturması, hidrolitik
enzimlerin bakteriyel proteinleri yıkması. Böylece, oksijen bağımlı
öldürme yolaklarında defektler olan hastaların bile bakterileri
öldürebilme yetenekleri bulunmaktadır. Bununla birlikte oksijen bağımlı
mekanizmaların daha etkin olması nedeniyle defektli hastalar daha
duyarlıdır ve daha ciddi enfeksiyonlar görülmektedir.
|
Tablo 4. Oksijen-bağımsız hücreiçi öldürme
mekanizmaları |
|
Etkin Molekül |
Fonksiyon |
|
Katyonik proteinler (katepsin dahil)
Lizozim
Laktoferrin
Proteolitik ve hidrolitik enzimler
|
Mikrobiyal membran hasarı
Bakteriyal hücre duvarı mukopeptit yarılması
Çoğalan bakterinin demirden mahrum bırakılması
Ölü organizmanın sindirimi
|
|
|
 Şekil
12 Şekil
12
Nitrik oksid-bağımlı öldürme |
NİTRİK OKSİT BAĞIMLI ÖLDÜRME
Özellikle Toll-like reseptörler vasıtasıyla bakterilerin makrofajlara
bağlanması TNF-alfa üretimi ile sonuçlanır. TNF-alfa indüklenebilir
nitrik oksit sentaz (i-nos) geninin ekpresyonunu otokrin tarzda
uyarmakta ve nitrik oksit üretimi (NO) gerçekleşmektedir (Şekil 12).
Eğer hücreler aynı zamanda interferon gama (IFN-gama)ya da maruz
kalmıssa fazladan NO üretimi gerçekleşecektir (Şekil 12). Hücreden
salınan nitrik oksit toksiktir ve makrofaj etrafında mikroorganizmayı
öldürebilir.
|
 Şekil 13 NK hücreler ve aktivasyonları
Şekil 13 NK hücreler ve aktivasyonları
 Şekil 14
Şekil 14
Opsonize hedefin K hücre tarafından öldürülmesi.
|
ÖZGÜL OLMAYAN ÖLDÜRÜCÜ HÜCRELER
NK hücreleri, LAK ve K hücreleri, aktive makrofajlar ve eozinofiller gibi çok
çeşitli hücreler yabancı ve değişime uğramış organizmanın kendi hücrelerini
özgül olmayan yollarla öldürme kapasitesine sahiptirler. Bu hücreler doğal immün
sistemde önemli rollere sahiptirler.
NK ve LAK hücreleri
Doğal öldürücü (NK) hücreler daha büyük olmaları ve çok sayıda granüllerinin
olması dışında morfolojik olarak lenfositlere benzemeleri nedeniyle aynı
zamanda büyük granüler lenfositler (LGL) olarak da bilinirler. NK hücreler
CD56 ve CD16 yüzey markerlarının varlığı ve CD3 bulunmaması ile identifiye
edilebilirler. NK hücreler virüsle enfekte ve malign hücreleri öldürebilme
yeteneğindedirler fakat görece olarak bu işlevlerinde verimli değillerdir.
Ancak, IL-2 ve IFN-gama maruziyeti üzerine malign hücreleri öldürebilme
kapasitesine sahip NK hücreler lenfokin aktive öldürücü hücreler (LAK)
olurlar. IL-2 ve IFN-gama maruziyetine devam edilmesi LAK hücrelerinin
malign hücreler gibi transforme hücreleri öldürenbilme yeteneği
sağlamaktadır. LAK hücre terapileri malignensilerin tedavisinde yeni bir
yaklaşımdır.
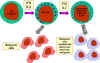
Peki, NK ve LAK hücreleri normal ile virüsle enfekte ve malign hücre
ayırımını nasıl yapmaktadır? NK ve LAK hücreleri yüzeylerinde iki çeşit
reseptör taşımaktadır: öldürücü aktive eden reseptör-killer activating
receptor (KAR) ve öldürücü inhibe eden reseptör- killer inhibiting receptor
(KIR). KAR ligandı (hedef hücre yüzeyindeki öldrürücü aktive eden ligand (KAL))
ile karşılaştığında NK veya LAK hücreleri hedefi öldürebilme
yeteneğindedirler. Ancak, KIRda aynı zamanda kendi ligandın bağlanırsa
öldürme işlemi KAR-KAL bağlanması olsa dahi inhibe olmaktadır. KIR için
ligandlar MHC-sınıf I molekülleridir. Böylece eğer bir hedef hücre sınıf I
MHC molekülü eksprese ediyorsa bu hücre NK veya LAK hücreleri tarafından
öldürülmeyecektir. Hatta bu durum hedef hücre aynı zamanda KARa
bağlanabilecek KAL taşısa dahi aynı olmaktadır. Normal hücreler sürekli
olarak yüzeylerinde MHC-I moleküllerini ekprese etmeye devam etmektedirler
bununla birlikte virüsle enfekte veya malign hücrelerde MHC sınıf I
molekülünün ekspresyonu azalmaktadır. Böylece NK ve LAK hücreleri normal
hücrelerden ayırarak virüs enfekte hücreleri ve kanser hücrelerini seçici
bir şekilde öldürmektedir.
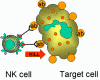
K hücreleri (Şekil 14)
Killer hücreleri (K) morfolojik olarak farklı hücreler değillerdir. Daha
doğrusu K hücreleri antikor bağımlı hücresel sitotoksisiteye (ADCC) aracılık
eden hücrelerdir. Antikor bağımlı hücresel sitotoksisitede antikor, öldürme
olayının gerçekleşebilmesi için K hücresi ile hedef hücreyi bir araya
getirmede bağ görevi görmektedir. K hücrelerin yüzeyinde antikorlar için Fc
reseptörleri taşımaktadır, böylece bu hücreler hedefi tanıyabilir,
bağlanabilir ve antikor kaplı hücreleri öldürebilirler. Öldürücü hücreler,
Fc reseptörlerine sahip NK, LAK hücreleri ve IgG için Fc reseptör taşıyan
makrofajlar ve IgE için Fc reseptörü bulunan eozinofillerdir.
|
| |
Özgül olmayan
immün sistemin tüm bileşenleri, antikor, interferon gama ve interlökünler
gibi özgül immün sistemin ürünleri tarafından ayarlanılmaktadır.
|
|
Aşağıdakileri bilmeniz gerekmektedir:
1. Özgül olmayan ve özgül immün fonksiyonlar.
2. Özgül olmayan immün sistemin humoral bileşenleri ve rolleri
3. Özgül olmayan immün sistemin hücresel bileşenleri ve rolleri
4. Bakterinin fagositler tarafından hücre içi öldürül yolları ve karakteristik
özellikleri
5. Özgül olmayan immün sistem üzerine interferon, TNF, IL-2, kompleman gibi
humoral bileşenlerin etkisi
|
|
Tableo 5. Özgül olmayan
dirençte hücrelerin özellikleri |
|
Efektör hücre |
Tanımlayıcı belirteçler ve/veya
fonksiyon |
|
CD3 |
Ig |
Fc |
CD |
Fagositoz |
|
Nötrofil
Makrofaj
NK hücresi
K-hücreleri
LAK hücresi
Eosinophil |
-
-
-
-
-
- |
-
-
-
-
-
- |
IgG
IgG
IgG
IgG
?
IgE |
CD67
CD14
CD56 & 16
?
?
CD67 |
+
+
-
-
?
-
|
|
|
 |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Sunday, March 20, 2016
Page maintained by
Richard Hunt
Please report any problems to richard.hunt@uscmed.sc.edu
|

 Şekil 4A
Şekil 4A  Şekil 5
Şekil 5 Şekil 10
Bakterinin reseptörler vasıtasıyla tutulması
Şekil 10
Bakterinin reseptörler vasıtasıyla tutulması Şekil 13 NK hücreler ve aktivasyonları
Şekil 13 NK hücreler ve aktivasyonları













