|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS |
VIROLOGÍA – CAPÍTULO CINCO
GENÉTICA DE LOS VIRUSDr Margaret Hunt
University of South Carolina School of Medicine
Columbia
SC
USA
Traducido por :
Sarah M. Castillo -
Jorge
Medico Pasante
Clinica Corominas
Santiago
Rep. Dominicana
|
|
BUSCAR |
|
|
|
|
|
|
|
|
|
OBJETIVOS
Introducción a la genética de los virus de animales
|
GENERALIDADES
Los virus
crecen rápidamente, usualmente hay un gran número de viriones progenie por
célula. Hay, por tanto, más probabilidad de que ocurran mutaciones en un corto
periodo de tiempo.
La
naturaleza del genoma viral (ARN o AND, segmentado o no segmentado) juega un
papel importante en la genética de los virus.
Los virus
pueden cambiar genéticamente a causa de mutaciones o mediante
recombinación
MUTANTES
ORIGEN
Mutaciones
Espontáneas
Estas
surgen naturalmente durante la replicación viral: i.e. a causa de errores por la
polimerasa de replicación del genoma o a causa de la incorporación de formas
tautoméricas de
las bases.
Los virus
de ADN tienden a ser más estables genéticamente que los virus de ARN. Existen
mecanismos de corrección de error en la célula huésped para la reparación del
ADN, pero no para la del ARN.
Algunos
virus de ARN son notablemente invariables en naturaleza. Es probable que estos
virus tengan la misma tasa de mutación que otros virus de ARN, pero que estén
tan adaptados a una transmisión y replicación de alta precisión, que cambios
mínimos resultarían en su fracaso a la hora de competir exitosamente con los
virus progenitores (en su forma original, “silvestres”). .
Mutaciones
inducidas por medios físicos o químicos
Químicos:
Agentes que
actúa directamente sobre las bases, i.e.: ácido nitroso
Agentes que actúan indirectamente, i.e.: análogos de bases que yerran en el
apareamiento más frecuentemente que las bases normales, generando así mutaciones
Físicos:
Agentes
como la luz ultravioleta o los rayos X
TIPOS DE
MUTACIONES:
Las
mutaciones pueden ser puntuales (una base es reemplazada por otra) o mutaciones
de inserción/supresión.
EJEMPLOS
DE LOS TIPOS DE CAMBIOS FENOTÍPICOS OBSERVADOS EN LOS VIRUS MUTANTES
(fenotipo =
las características observadas de un organismo)
Mutantes
letales condicionales:
Estos
mutantes se multiplican bajo ciertas condiciones pero no en otras (mientras que
los virus tipo “silvestres” (en su forma original) crecen bajo cualquier tipo de
condición)
i.e.
Mutantes termo sensibles (ts) – Estos crecen a bajas
temperaturas i.e. 31 grados C pero no crecen a i.e. 39 grados C, los de tipo
“silvestres” crecen tanto a 31 como a 39 grados C. Parece que la razón de esto
es que la proteína alterada no puede mantener una conformación funcional a
elevadas temperaturas.
i.e.
La gama de las células huésped – Estos mutantes sólo crecen en un
subgrupo particular de células – dichos mutantes proveen un medio para
investigar el papel de las células huésped en la infección viral
Tamaño de
la placa:
Las placas
pueden ser mayores o menores con el virus de tipo “silvestre”, a veces algunos
mutantes muestran patogenicidad alterada
Resistencia
a fármacos:
Esto es
importante en el desarrollo de agentes antivirales – la posibilidad de
surgimiento de variantes mutantes siempre debe de ser considerada
Mutantes
enzima-deficientes: Algunas
enzimas virales no son siempre esenciales y por tanto se pueden aislar variantes
mutantes viables que tienen deficiencias de enzimas; i.e. la enzima
timidina kinasa
del virus herpes simples generalmente no se necesita cuando se está cultivando
en tejido pero es importante para la infección de células neuronales.
Mutantes "Calientes": Estos
crecen mejor a altas temperaturas que los virus de tipo “silvestre”. Pueden ser
más virulentos puesto que aún cuando sean pirogénicos, la fiebre del huésped no
tendrá gran efecto sobre los mismos, pero sí retardarían la replicación de los
viriones ‘silvestres’.
Mutantes
atenuados: Muchos
virus mutantes causan síntomas menos severos (o ningún síntoma del todo) en
comparación con el virus progenitor – se dice que éstos mutantes están
atenuados. Estos
tienen un rol potencial en el desarrollo de vacunas y también son herramientas
útiles para la determinación de la manera en que el virus progenitor es
perjudicial.
|
 Figura 1 Recombinación de tipo “copy choice” (copia opción)
Figura 1 Recombinación de tipo “copy choice” (copia opción) |
INTERCAMBIO DE MATERIAL GENÉTICO
RECOMBINACIÓN
Intercambio
de material genético entre dos genomas.
Recombinación "clásica"
Esto
implica la ruptura de enlaces covalentes dentro del ácido nucleico, intercambio
de información genética, y la reformación de los enlaces covalentes.
Este tipo
de recombinación de ruptura/reparación es común en los virus de ADN o en
aquellos virus de ARN que tienen una fase de ADN (retrovirus). La célula huésped
tiene sistemas de recombinación para el ADN.
La recombinación de este tipo es muy rara en los virus de ARN (probablemente no
existan enzimas en el huésped para la recombinación del ARN). Los picornavirus
muestran una forma de recombinación de muy baja eficiencia. El mecanismo no es
idéntico al mecanismo estándar para el ADN, y es probablemente un mecanismo de
tipo "copy
choice" (copia-opción) (figura 1) en la que la polimerasa intercambia
de plantilla mientras copia el ARN.
|
 Figura
2 Rescate de marcador Figura
2 Rescate de marcador |
La
recombinación también es común en los coronavirus – también el mecanismo es
diferente a aquél que involucra ADN y probablemente es consecuencia de la
inusual forma en que se sintetiza el ARN en estos virus.
Hasta ahora,
no hay evidencia de recombinación en los virus de ARN de sentido negativo dando
lugar a variantes viables (En estos virus, el ARN genómico es empacado en la
nucleocápside y no está disponible para apareamiento de bases).
Usos
diversos de las técnicas de recombinación
a) Mapear o
cartografiar genomas (mientras más alejados estén dos genes, hay más
probabilidad de que se de un evento recombinante entre ellos).
b) Rescate
de Marcador – Los fragmentos de AND de un virus “de tipo silvestre”
pueden recombinarse con virus mutantes para generar virus ‘silvestres’ – esto
ofrece un medio para asignar funciones a regiones particulares del genoma.
También ofrece un medio para insertar material genético exterior dentro del gen
(figura 2).
La recombinación permite que un virus tome información genética de otros virus
del mismo tipo y en ocasiones, de virus no relacionados y hasta del genoma de la
célula huésped (como ocurre con algunos retrovirus – refiérase a
retrovirus).
|
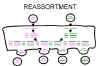 Figura 3 Reordenamiento de genoma viral en virus segmentados.
Figura 3 Reordenamiento de genoma viral en virus segmentados. |
Re-arreglo
o Reordenamiento
Si un virus
tiene un genoma segmentado y si dos variantes de ese virus infectan una misma
célula, los viriones progenie pueden resultar con algunos segmentos de un
progenitor, y con otros segmentos del otro progenitor.
Este es un
proceso eficiente – pero limitado a los virus con genomas segmentados – hasta
ahora el único virus humano caracterizado por genomas segmentados son los virus
de ARN i.e. ortomixovirus, reovirus, arenavirus, bunyavirus.
El re-arreglo
o reordenamiento puede jugar un papel importante en la naturaleza al generar
nuevos reordenamientos y también es útil en experimentos de laboratorio (figura
3). También ha sido explotado su uso en la asignación de funciones a diferentes
segmentos del genoma. Por ejemplo, en un virus reordenado, si uno de los
segmentos viene de un virus ‘A’ y el resto viene de un virus ‘B’, se pueden
determinar cuáles de sus propiedades son similares a las de un virus ‘A’ y
cuáles a las de un virus ‘B’.
El re-arreglo
o reordenamiento es un tipo de recombinación no – clásico.
|
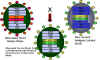 Figura 4 Reordenamiento de genes entre una cepa atenuada de un virus de
influenza y una nueva cepa virulenta en la formación de una vacuna
atenuada para la influenza (enlace
a la sección de vacunas)
Adaptado de Treanor JJ Infect. Med. 15:714
Figura 4 Reordenamiento de genes entre una cepa atenuada de un virus de
influenza y una nueva cepa virulenta en la formación de una vacuna
atenuada para la influenza (enlace
a la sección de vacunas)
Adaptado de Treanor JJ Infect. Med. 15:714 |
Genética
Aplicada
Existe una nueva
vacuna (aprobada en Junio 2003) para el virus de la influenza la cual se
desarrolló con la aplicación de algunos de los principios anteriormente
discutidos. La vacuna es trivalente – contiene 3 cepas del virus de la
influenza:
Los virus son cepas adaptadas al frío
que pueden crecer bien a 25 grados C y por tanto crecer en el tracto
respiratorio superior en donde la temperatura es menor. Los virus son termo –
sensibles y crecen pobremente en el más cálido tracto respiratorio inferior. Los
virus son cepas atenuadas y mucho menos patogénicas que los virus de ‘tipo
silvestre’. Esto se debe a múltiples cambios en los diferentes segmentos
genómicos.
Proteínas de superficie de los
anticuerpos para el virus de la influenza (HA -
hemaglutinina
y NA -
neuraminidasa)
son importantes en la protección contra las infecciones. La HA y NA cambian
anualmente. La tecnología de las vacunas utiliza el reordenamiento para generar
virus reordenados que tengan seis segmentos genómicos de los virus atenuados
adaptados al frío y segmentos codificadores de las HA y NA del virus, y esto es
probablemente un problema en la temporada de influenza venidera.
Dicha vacuna (FluMist) es una vacuna
de virus vivos y se administra intranasalmente como un atomizador y puede
inducir inmunidad en las mucosas y sistémica.
|
| |
COMPLEMENTACIÓN
Es la
interacción a nivel funcional NO a nivel del ácido nucleico. Por ejemplo, si
tomamos dos mutantes con una lesión ts (termo – sensibilidad) en
diferentes genes, ninguno puede crecer a altas temperaturas. Si infectamos una
misma célula con ambos mutantes, cada mutante proveerá la función faltante del
otro y por tanto se pueden replicar (sin embargo, los viriones progenie tendrán
genomas ts mutantes y ser termo – sensibles).
Se puede
utilizar la complementación para combinar mutantes ts, puesto que estos mutantes
ts usualmente no se complementarán en el mismo gen. Esta es una herramienta
básica en Genética para determinar si una mutación se encuentra en un solo o en
diferentes genes y para determinar y mínimo número de genes que afectan una
función.
|
| |
REACTIVACIÓN POR MULTIPLICIDAD
Si un virus
de ADN de cadena doble es inactivado con irradiaciones ultravioleta, usualmente
se puede observar reactivación del mismo si se infectan células con una
multiplicidad alta del virus inactivado (i.e. muchas partículas virales por
célula) – esto ocurre porque los virus inactivos cooperan en alguna manera.
Probablemente la complementación permita a los virus crecer inicialmente, puesto
que genes inactivados en un virión pueden estar activos en otro. A medida que el
número de genomas presentes crezca por replicación, la recombinación puede
ocurrir, resultando en nuevos genotipos, y a veces regenerando un virus de tipo
‘silvestre’.
VIRUS
DEFECTUOSOS
Los virus
defectuosos carecen del complemento completo de genes necesarios para completar
un ciclo de infección (muchos son mutantes por supresiones) – y por tanto,
necesitan otro virus que provea las funciones faltantes – a este segundo virus
se le llama virus ayudante.
Los virus
defectuosos deben dar las señales apropiadas para que la polimerasa replique sus
genomas y para que sus genomas sean empacados. Aunque no necesitan dar más
señales de ahí, algunos virus lo hacen.
Algunos
ejemplos de virus defectuosos:
Algunos
retrovirus han tomado secuencias de la célula huésped pero han perdido algunas
funciones virales. Estos necesitan de un virus asociado que retenga estas
funciones como un ayudante.
Algunos
virus defectuosos pueden usar virus no relacionados como ayudantes. Por ejemplo,
el
virus de la hepatitis delta
(un virus de ARN) no codifica sus propias proteínas de envoltura pero usa la
envoltura del virus de la hepatitis B (un virus de AND).
PARTÍCULAS
DEFECTUOSAS INTERFERENTES
La
replicación del virus ayudante puede ser menos eficaz con el virus defectuoso (partícula)
que en la ausencia de este. Esto ocurre porque la partícula defectuosa compite
con el ayudante por las funciones del mismo. Este fenómeno se conoce como
interferencia, y las partículas defectuosas que causan este fenómenos se conocen
como “partículas defectuosas interferentes (DI)”. Muchos de los virus
defectuosos son interferentes.
Note que es
posible que una particular defectuosa interferente module una infección natural.
|
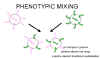 Figura 5 Mezcla de fenotipos entre dos virus diferentes que infectan la
misma célula
Figura 5 Mezcla de fenotipos entre dos virus diferentes que infectan la
misma célula |
MEZCLA DE
FENOTIPOS
Si dos
virus diferentes infectan una célula, los virus progenie pueden contener
componentes en su envoltura que deriven de ambos progenitores y por tanto
tendrán características de ambos en sus envolturas. Esto se llama mezcla de
fenotipos (figura 5). NO IMPLICA ALTERACIÓN DE MATERIAL GENÉTICO, la progenie de
estos viriones estará determinada por el genoma progenitor que sea empacado y no
por la naturaleza de la envoltura.
La mezcla fenotípica puede ocurrir entre virus relacionados, i.e. diferentes
miembros de la familia de los picornavirus, o puede ocurrir entre virus
genéticamente no relacionados, i.e. rabdo – y paramixo - -virus. En este último
caso, los dos virus involucrados son generalmente virus envueltos puesto que, al
parecer, hay menos restricciones en el empacado de las nucleocápsides dentro de
envolturas de otros virus que en el empacado de ácidos nucleicos en cápsides
icosaédricas de otros virus.
|
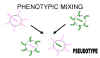 Figura 6 Mezcla fenotípica para crear un pseudotipo
Figura 6 Mezcla fenotípica para crear un pseudotipo |
También se puede dar la situación en que una envoltura sea completamente de otro
virus, i.e. una nucleocápside de un retrovirus en una envoltura de un rabdovirus.
Este tipo de mezcla fenotípica es conocida también como formación de pseudotipo
(pseudovirión) (figura 6). El pseudotipo descrito mostrará las características
de fijación – penetración – antigenicidad de superficie de un rabdovirus y luego,
al ocurrir una infección, mostrará comportamiento de retrovirus y producirá una
progenie de retrovirus. Esto resulta en pseudotipos que tendrán, en un contexto
temporal, un tropismo huésped/tejido de rango alterado.
|
|
|
 Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Esta página se modificó
recientemente en
Saturday, February 07, 2015
Mantenimiento de la pagina por
Richard Hunt
|

 Figura 3 Reordenamiento de genoma viral en virus segmentados.
Figura 3 Reordenamiento de genoma viral en virus segmentados.  Figura 4 Reordenamiento de genes entre una cepa atenuada de un virus de
influenza y una nueva cepa virulenta en la formación de una vacuna
atenuada para la influenza (enlace
a la sección de vacunas)
Adaptado de Treanor JJ Infect. Med. 15:714
Figura 4 Reordenamiento de genes entre una cepa atenuada de un virus de
influenza y una nueva cepa virulenta en la formación de una vacuna
atenuada para la influenza (enlace
a la sección de vacunas)
Adaptado de Treanor JJ Infect. Med. 15:714 Figura 5 Mezcla de fenotipos entre dos virus diferentes que infectan la
misma célula
Figura 5 Mezcla de fenotipos entre dos virus diferentes que infectan la
misma célula Figura 6 Mezcla fenotípica para crear un pseudotipo
Figura 6 Mezcla fenotípica para crear un pseudotipo