|
|
|
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA – CAPÍTULO SETE
IMUNOGLOBULINAS- REAÇÕES ANTIGENO-ANTICORPO E TESTES SELECIONADOS
Dr.
Gene Mayer
Professor Emeritus
University of South Carolina School of Medine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS
|
|
EM ESPANHOL |
|
SHQIP - ALBANIAN |
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
|
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|

 |
|
|
|
OBJETIVOS
Descrever a natureza das reações Ag-Ac
Comparar e diferenciar afinidade e avidez de anticorpos
Delienar a base para a especificidade e
reatividade cruzada de anticorpos
Discutir os princípios dos testes cumumente usados em reações
antígeno/anticorpo
 Figura 1
Figura 1 |
NATUREZA DAS
REAÇÕES ANTÍGENO-ANTICORPO
Conceito de Chave e Fechadura
O sítio de combinação de um
anticorpo é localizado na porção Fab da molécula e é construído a partir de
regiões hipervariáveis
de cadeias pesadas e leves. Estudos de cristalografia por raios X das
interações antígeno-anticorpo mostram que o determinante antigênico se
aninha em uma fenda formada pelo sítio de combinação do anticorpo como
ilustrado na Figura 1. Dessa forma, nosso conceito de reações
antígeno-anticorpo é o de uma chave (i.e. o antígeno) que cabe em uma
fechadura (i.e. o anticorpo).
Ligações Não-covalentes
As ligações que unem o antígeno ao sítio de ligação do anticorpo são todas
não-covalentes por natureza. Elas incluem pontes de hidrogênio, ligações
eletrostáticas, forças de Van der Waals e hidrofóbicas. Ligações múltiplas
entre o antígeno e o anticorpo garantem que o antígeno será ligado
fortemente ao anticorpo.
Reversibilidade
Uma vez que as reações antígeno-anticorpo ocorrem via
ligações não-covalentes, elas são por natureza reversíveis.
|
|
PALAVRAS CHAVE
Affinity
Avidez
Especificidade
Reatividade cruzada
Aglutinação
Hemaglutinação
Aglutinina
Titragem
Pro-zona
Hemaglutinação passiva
Teste de Coombs Direto
Teste de Coombs Indireto
Inibição de hemaglutinação
Ponto de equivalência
Excesso de anticorpo
Excesso de antígeno
Imunodifusão radial
Imunoeletroforese
Contraimunoeletroforese
Radioimunoensaio
Ensaio Imunoadsorvente Ligado à Enzima
RIA/ELISA Competitivo
RIA/ELISA Não Competitivo
Imunofluorescência
Citometria de fluxo
Fixação do complemento
 Figura
2
Figura
2
 Figura
3
Figura
3
 Figura
4
Figura
4
 Figura
5
Figura
5 |
AFINIDADE E
AVIDEZ
Afinidade
Afinidade de um anticorpo é a força da reação entre um único determinante
antigênico e um único sítio de combinação no anticorpo. É a soma das forças
de atração e repulsão que operam entre o determinante antigênico e o sítio
de combinação do anticorpo, como ilustrado na Figura 2.
Afinidade é
a constante de equilíbrio que descreve a reação antígeno-anticorpo, como
ilustrado na Figura 3. A maioria dos anticorpos têm uma elevada afinidade
por seus antígenos.
Avidez
Avidez é uma medida da força total de ligação de um antígeno
contendo muitos determinantes antigênicos e anticorpos multivalentes. A
avidez é influenciada tanto pela valência do anticorpo como pela valência do
antígeno. Avidez é mais que a soma de afinidades individuais. Isto é
ilustrado na Figura 4.
Repetindo,
afinidade se refere à força de ligação entre um único determinante
antigênico e um sítio de combinação de um anticorpo particular, enquanto que
avidez se refere à força total de ligação entre antígenos e anticorpos.
ESPECIFICIDADE E REATIVIDADE CRUZADA
Especificidade
Especificidade se refere à abilidade de um sítio de combinação de
anticorpo em particular de reagir com apenas um antígeno. Em geral, há
um elevado grau de especificidade nas reações antígeno-anticorpo.
Anticorpos podem distinguir diferenças em 1) estrutura primária de um
antígeno, 2) formas isoméricas de um antígeno, e 3) estrutura secundária
e terciária de um antígeno.
Reatividade cruzada
Reatividade cruzada se refere à habilidade de um sítio de combinação de
anticorpo em particular de reagir com mais de um determinante antigênico
ou a habilidade de uma população de moléculas de anticorpos de reagir
com mais de um antígeno. A Figura 5 ilustra como reações cruzadas podem
ocorrer. Reações cruzadas aparecem porque o antígeno envolvido na reação
cruzada compartilha um mesmo
epitopo
com o antígeno imunizador ou porque ele tem um epitopo que é
estruturalmente semelhante ao epitopo no antígeno imunizante
(multi-especificidade).
TESTES
DE REAÇÃO ANTÍGENO-ANTICORPO
Fatores que afetam a medição de reações antígeno-anticorpo
A única forma de se saber se uma reação antígeno-anticorpo ocorreu é
descobrir um jeito de detectar direta ou indiretamente os complexos
formados entre o antígeno e o anticorpo. A facilidade da escolha sobre
qual deles poderá detectar as reações antígeno-anticorpo vai depender de
vários fatores.
Afinidade
Quanto maior a afinidade do anticorpo pelo antígeno, mais estável
será a interação. Nesse caso, a facilidade com que se pode detectar
a interação é maior.
Avidez
Reações entre antígenos multivalentes e anticorpos multivalentes são
mais estáveis e portanto mais fáceis de detectar.
|
 Figura
6
Figura
6 |
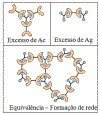
Razão entre antígeno e anticorpo
A razão entre o antígeno e o anticorpo influencia a detecção dos
complexos antígeno-anticorpo porque o tamanho dos complexos está
relacionado com a concentração do antígeno e do anticorpo. Isto é
mostrado na Figura 6.
Forma física do antígeno
A forma física do antígeno influencia em como se detecta sua
reação com um anticorpo. Se o antígeno é particulado, geralmente
se observa a aglutinação do antígeno pelo anticorpo. Se o
antígeno é solúvel, geralmente se pesquisa a precipitação de um
antígeno após a produção de grandes complexos antígeno-anticorpo
insolúveis.
|
 Figura 7
Figura 7 |
Testes
de Aglutinação
Aglutinação/Hemaglutinação
Quando um antígeno é particulado, a reação de um anticorpo com o
antígeno pode ser detectada pela aglutinação (agrupamento) do antígeno.
O termo geral aglutinina é usado para descrever anticorpos que aglutinam
antígenos particulados. Quando o antígeno é um eritrócito é usado o
termo
hemaglutinação.
Todos os anticorpos podem teoricamente aglutinar antígenos particulados
mas IgM, devido à sua elevada valència, é particularmente uma boa
aglutinina e se pode às vezes inferir que um anticorpo deve ser da clase
IgM se for um bom anticorpo aglutinador.
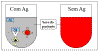
Teste de aglutinação qualitativo
Testes de aglutinação podem ser usados de maneira qualitativa para
investigar a presença de um antígeno ou um anticorpo. O anticorpo é
misturado com o antígeno particulado e um teste positivo é indicado
pela aglutinação do antígeno particulado. (Figura 7).
Por exemplo, células vermelhas do sangue de um
paciente podem ser misturadas com um anticorpo dirigido a um
antígeno de grupo sanguíneo para determinar o tipo sanguíneo da
pessoa. Em um segundo exemplo, o soro de um paciente é misturado com
células vermelhas do sangue de um tipo sanguíneo conhecido para
pesquisar pela presença de anticorpos para aquele tipo sanguíneo no
soro do paciente.
|
 Figura 8
Figura 8 |
Teste de aglutinação qualitativo
Testes de aglutinação podem também ser usados para medir o nível de
anticorpos para antígenos particulados. Neste teste, é realizada uma
diluição seriada de uma amostra a ser testada para anticorpos e a
seguir é adicionado um número fixo de células vermelhas sanguíneas,
bactérias ou outro antígeno particulado. Em seguida é determinada a
diluição máxima que ainda permite aglutinação. A diluição máxima que
ainda permite aglutinação visível é chamada de
título.
Os resultados são descritos como a recíproca entra a diluição máxima
que ainda permite aglutinação visível. A Figura 8 ilustra o teste
quantitativo de hemaglutinação.
Efeito prozona – Ocasionalmente é observado que
quando a concentração do anticorpo é elevada (i.e. diluições
menores) não há aglutinação, mas quando a amostra é posteriormente
diluida ocorre a aglutinação (Veja Paciente 6 na Figura 8). A
ausência de aglutinação em altas concentrações de anticorpos é
chamada de efeito
prozona.
A ausência de aglutinação no efeito prozona é devida ao excesso de
anticorpos resultando em complexos muito pequenos que não se
aglomeram para produzir aglutinação visível.
|
| |
Aplicações dos testes de aglutinação
Determinação dos tipos sanguíneos ou de anticorpos para
antígenos de grupos sanguíneos.
iAvaliar infecções bacterianas
ex.
O aumento em título de um anticorpo dirigido a uma
bactéria em particular indica uma infecção por aquele
tipo bacteriano. N.B. um quadruplo em aumento do título
é geralmente considerado como um aumento significante de
título de anticorpos.
Considerações práticas
Embora o teste seja de fácil execução, é apenas
semi-quantitativo.
|
 Figura
9
Figura
9 |
Hemaglutinação passiva
Os testes de aglutinação só funcionam com antígenos particulados.
Entretanto, é possível se cobrir eritrócitos com um antígeno solúvel
(ex. Antígeno viral, um polissacarídeo ou hapteno) e usar as células
vermelhas sanguéneas cobertas em um teste de aglutinação com
anticorpos para o antígeno solúvel (Figura 9). Issso é chamado de
hemaglutinação passiva. O teste é realizado tal como o teste de
aglutinação. As aplicações incluem a detecção de anticorpos para
antígenos solúveis e detecção de anticorpos para antígenos virais.
|
 Figura
10
Figura
10 |
Teste de
Coombs (Teste de Antiglobulina)
Teste de Cooms Direto
Quando anticorpos se ligam a eritrócitos, eles nem sempre resultam em
aglutinação. Isso pode se dever à relação antígeno/anticorpo, em que o
antígeno em excesso, o anticorpo em excesso ou em alguns casos cargas
elétricas nas células vermelhas sanguíneas prejudicam a eficiência da
ligação cruzada entra as células. Esses anticorpos que ligam mas não
causam aglutinação das células vermelhas sanguíneas são às vezes
referidos como anticorpos incompletos. Isso não quer dizer de forma
nenhuma que os anticorpos sejam diferentes em sua estrutura, embora isso
seja o que se pensava que fosse o caso. Pelo contrário, esta é uma
definição apenas funcional. Para detectar a presença de anticorpos
não-aglutinadores nas células vermelhas sanguíneas, simplesmente se
adiciona um segundo anticorpo diretamente contra a imunoglobulina
(anticorpo) que cobre as células vermelhas. Esta anti-imunoglobulina
pode agora fazer reação cruzada com as células vermelhas sanguíneas e
levar à aglutinação. Este teste é ilustrado na Figura 10 e é conhecido
como teste de Coombs Direto.

|
 Figura
11
Figura
11 |
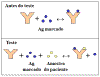
Teste de Coombs Indireto
Se for necessário saber se uma amostra de soro tem anticorpos
dirigidos contra uma célula vermelha sanguínea em particular e
você quer se assegurar de que também vai detectar anticorpos
não-aglutinadores potenciais na amostra, é realizado um teste de
Coombs Indireto (Figura 11). Este teste é feito incubando as
células vermelhas sanguíneas com a amostra de soro, lavando-se
para retirar quaisquer anticorpos não ligados e depois
adicionando um segundo reagente anti-imunoglobulina para fazer
ligação cruzada com as células.

Aplicações
Entre estas se incluem a detecção de anticorpos (Rh)
anti-fator
rhesus. Anticorpos contra o fator Rh geralmente não
aglutinam células vermelhas sanguíneas. Portanto, células
vermelhas de crianças Rh+ nascidas de mães Rh-
, que têm anticorpos anti-Rh, devem estar cobertas por esses
anticorpos. Para verificar isso, é realizado um teste de Coombs
direto. Para ver se a mãe têm anticorpos anti-Rh no seu soro se
realiza um teste de Coombs Indireto.
|
 Figura
12
Figura
12 |
Inibição de Hemaglutinação
O teste de aglutinação pode ser modificado para ser usado na
medição de antígenos solúveis. Este teste é chamado inibição de
hemaglutinação. É chamado inibição de hemaglutinação porque é
medida a habilidade de um antígeno solúvel de inibir a
aglutinação por anticorpos de células vermelhas sanguíneas
cobertas por antígenos. Neste teste, uma quantidade fixa de
anticorpos dirigidos ao antígeno em questão é misturada com uma
quantidade fixa de células vermelhas sanguíneas cobertas com o
antígeno (veja hemaglutinação passiva acima). Também estão
incluidas na mistura diferentes quantidades da amostra a ser
analizada para a presença do antígeno. Se a amostra contém o
antígeno, o antígeno solúvel irá competir com o antígeno que
cobre as células vermelhas sanguíneas pela ligação com os
anticorpos, inibindo dessa forma a aglutinação das células
vermelhas sanguíneas, como ilustrado na Figura 12.
Pela diluição seriada da amostra você pode
quantificar o antígeno na sua amostra desconhecida pelo seu
título. Este teste é geralmente usado para quantificar antígenos
solúveis e é sujeito às mesmas considerações práticas do teste
de aglutinação.
|
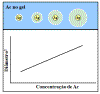 Figura 13
Figura 13 |
Testes de precipitação
Imunodifusão Radial (Mancini)
Na imunodifusão radial o anticorpo é incorporado no gel de ágar
quando este for derramado e diluições diferentes do antígeno são
aplicadas nos poços perfurados no agar. À medida que o antígeno
se difunde no gel ele reage com o anticorpo e quando o ponto de
equivalência é atingido é formado um anel de precipitação,
conforme é ilustrado na Figura 13.
O diâmetro do anel é proporcional ao log da
concentração do antígeno, uma vez que a quantidade de anticorpo
é constante. Portanto, ao correr diferentes concentrações de um
antígeno padrão pode-se gerar uma curva padrão a partir da qual
se pode quantificar a quantidade de um antígeno em uma amostra
desconhecida. Por essa razão, este é um teste quantitativo. Se
aparecerem no teste mais de um anel, ocorreram mais de uma
reação antígeno/anticorpo. Isso pode ser devido à mistuda de
antígenos ou de anticorpos. Este teste é comumente usado em
laboratório clínico para a determinação dos níveis de
imunoglobulina em amostras de pacientes.
|
 Figura
14
Figura
14 |
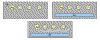
Imunoeletroforese
Em imunoeletroforese, uma mistura complexa de antígenos é
aplicada em um poço perfurado em um gel de ágar e os antígenos
são submetidos à eletroforese, de forma que os antígenos são
separados de acordo com suas cargas. Após a eletroforese, um
sulco é feito no gel e os anticorpos são adicionados. À medida
que os anticorpos se difundem no ágar são produzidas linhas de
precipitina na zona de equivalência quando ocorre uma reação
antígeno/anticorpo, conforme ilustrado na Figura 14.
Este teste é usado para a análise qualitativa de
misturas complexas de antígenos, embora uma medida grosseira da
quantidade (espessura da linha) pode ser obtida. Este teste é
comumente usado para a análise de componentes no soro de um
paciente. O soro é colocado no poço e anticorpos para soro total
é colocado no sulco. Através da comparação com o soro normal, é
possível determinar se há deficiências em um ou mais componentes
do soro ou se há uma super-abundância de algum dos componentes
do soro (espessura da linha). Este teste pode também ser usado
para avaliar a pureza das proteínas de soro isoladas.
|
 Figura
15
Figura
15 |
Eletroforese contracorrente
Neste teste o antígeno e o anticorpo são colocados em poços perfurados
no gel de ágar e o antígeno e o anticorpo são submetidos à eletroforese
um contra o outro, onde eles formam uma linha de precipitação como
ilustrado na Figura 15. Este teste somente funciona se forem conseguidas
as condições em que em que o antígeno e o anticorpo tenham cargas
opostas. Este teste é primariamente qualitativo, embora a partir da
espessura da banda você possa obter alguma medida da quantidade. Sua
maior vantagem é a rapidez.
|
 Figura
16
Figura
16
 Figura
17
Figura
17 |
Radioimunoensaio (RIA)/Ensaio Enzimático de Imunoabsorção (ELISA)
Radioimunoensaios (RIA) são ensaios baseados na medição da
radioatividade associada com complexos imunes. Em um teste particular, o
marcador pode ser tanto o antígeno como anticorpo. Ensaios enzimáticos
de Imunoabsorção (ELISA) são aqueles que são baseados na medição de uma
reação enzimática associada com complexos imunes. Em um teste em
particular, a enzima deve esta ligada ao antígeno ou ao anticorpo.
RIA/ELISA Competitivo para Detecção de Ac
O método e o princípio do RIA e ELISA para a medição de antígeno é
mostrado na Figura 16. Pelo uso de quantidades conhecidas de um
antígeno padrão não marcado pode-se gerar uma curva padrão,
relacionando a radioatividade da enzima ligada versus quantidade do
antígeno. A partir desta curva padrão pode-se determinar a
quantidade de um antígeno em uma amostra desconhecida.
O
ponto crucial do teste é a separação dos complexos imunes do
restante dos componentes. Isso pode ser conseguido em muitas
maneiras diferentes que servem como base para o nome atribuido ao
ensaio:
Precipitação por sulfato de amônia
Sulfato de amônia (concentração final 33 - 50%) irá precipitar
imunoglobulinas mas não muitos antígenos. Esta também é chamada
técnica de Farr.
Anticorpo anti-imunoglobulina
A adição de um segundo anticorpo dirigido contra o primeiro
anticorpo pode resultar na precipitação de complexos imunes e
consequentemente na separação dos complexos e antígenos livres.
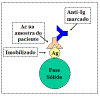
Imobilização do Anticorpo
O anticorpo pode ser imobilizado na superfície de uma pérola de
plástico ou cobrindo a superfície de uma placa de plástico e
assim os complexos imunes podem facilmente ser separados dos
outros componentes pela simples lavagem das pérolas ou da placa
(Figura 17). Este é o método mais comumente usado hoje em dia e
é referido como RIA ou ELISA de fase Sólida. No laboratório
clínico, RIA e ELISA competitivo são comumente usados para
quantificar proteínas séricas, hormônios e metabólitos de
drogas.
|
|
TUTORIAL
EM INGLÊS
TESTE ELISA
HHMI
Requer Flash
|
 Figura
18
Figura
18
 Figura
19
Figura
19 |
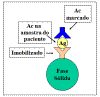
RIA/ELISA não-competitivo para Ag ou Ac
RIA e ELISAs não competitivos são também usados para a medição de
antígenos e anticorpos. Na Figura 18, a pérola é coberta pelo
antígeno e é usada para a detecção de anticorpo na amostra
desconhecida. A quantidade do segundo anticorpo marcado ligado está
relacionada com a quantidade de anticorpo na amostra desconhecida.
Este ensaio é comumente empregado para a medição de anticorpos da
classe IgE dirigidos contra um alergeno em particular, pelo uso de
um antígeno e anticorpos anti-IgE como reagente marcador. Isto se
chama de teste RAST (teste radio-alergo-absorvente). Na figura 19, a
pérola está coberta com anticorpo e é usada para medir um antígeno
desconhecido. A quantidade do segundo anticorpo marcado que liga é
porporcional à quantidade do antígeno que se liga ao primeiro
anticorpo.
|
 Figura
20
Figura
20 |
Testes para Antígenos Associados a Células
Imunofluorescência
Imunofluorescência é a técnica pela qual um anticorpo marcado
com uma molécula fluorescente (fluoresceína, rodamina ou um dos
vários outros corantes fluorescentes) é usado para detectar a
presença de um antígeno dentro ou sobre uma célula ou tecido,
pela fluorescência emitida pelo anticorpo ligado.
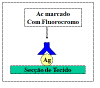
Imunofluorescência Direta
Na imunofluorescência direta, o anticorpo específico para o
antígeno é diretamente marcado com o
fluorocromo
(Figura 20).
|
 Figura
21
Figura
21 |
Imunofluorescência Indireta
Na imunofluorescência indireta, o anticorpo específico para o
antígeno não é marcado e um segundo anticorpo
anti-imunoglobulina dirigido ao primeiro anticorpo é marcado com
o
fluorocromo
(Figura 21). Fluorescência indireta é mais sensível do que a
imunofluorescência direta, uma vez que há amplificação do sinal.
|
 Figura
22
Figura
22 |
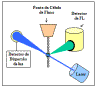
Citometria de Fluxo
Citometria de fluxo é comumente usada em laboratório clínico para
identificar e enumerar células contendo um antígeno particular. As
células em suspensão são marcadas com um marcador fluorescente pela
imunofluorescência direta ou indireta. As células são então
analizadas no citômetro de fluxo.
A Figura 22 ilustra o princípio da citometria
de fluxo. Em um citômetro de fluxo as células saem de uma
célula de fluxo e são iluminadas por um raio laser. A
quantidade de raios laser que é dispersa para fora das
células durante a passagem das mesmas pelo laser pode ser
medida, o que proporciona informação a respeito do tamanho
das células. Além disso, o laser pode excitar o fluorocromo
nas células e a luz fluorescente emitida pode ser medida por
um ou mais detectores.
|
 Figura
23
Figura
23 |
O tipo de dado que é obtido pela citometria de fluxo é mostrado
na Figura 23. Em um histograma mono-paramétrico o aumento da
fluorescência (ex. Fluorescência verde) é plotado no eixo dos
x e o número de células exibindo aquela quantidade de
fluorescência é plotado no eixo dos y. A fração de
células que são fluorescentes pode ser determinado pela
integração da área sob a curva. Em um histograma bi-paramétrico,
o eixo dos x é um parâmetro (ex. Fluorescência vermelha)
e o eixo dos y é o segundo parâmetro (ex. Fluorescência
verde). O número de células é indicado pelo contôrno e pela
intensidade da cor.
|
 Figura
24
Figura
24
|
Fixação do Complemento
Complexos antígeno/anticorpo podem também ser medidos por suas
habilidades de fixar o complemento porque um complexo antígeno/anticorpo
irá “consumir” o complemento se estiver presente, enquanto que antígenos
livres ou anticorpos não irão. Testes para complexos antígeno/anticorpo
que se baseiam no consumo do complemento são denominados testes de
fixação de complemento e são usados para quantificar reações
antígeno/anticorpo. Este teste só irá funcionar com anticorpos que fixam
complementos (IgG e IgM são os melhores).
O princípio do teste de fixação do complemento está ilustrado na Figura
24. O antígeno é misturado com o soro teste para ser investigado para
presença de anticorpos e é aguardada a formação de complexos
antígeno/anticorpo. Um tubo controle no qual nenhum antígeno é
adicionado também é preparado. Se nenhum complexo antígeno/anticorpo
estiver presente no tubo, nenhum complemento será fixado. Entretanto, se
complexos antígeno/anticorpo estiverem presentes eles irão fixar o
complemento e consequentemente diminuir a quantidade de complemento no
tubo. Após se aguardar a fixação do complemento por quaisquer complexos
antígeno/anticorpo, é adicionada uma quantidade padrão de células
vermelhas sanguíneas, previamente cobertas com anticorpos
anti-eritrócitos. A quantidade de células vermelhas sanguíneas cobertas
por anticorpos é predeterminada para ser suficiente para usar todo o
complemento inicialmente adicionado, se este ainda estivesse lá. Se todo
o complemento ainda estivesse presente (i.e., nenhum complexo
antígeno/anticorpo se formou entre o antígeno e o anticorpo em questão),
todas as células vermelhas serão lisadas. Se complexos
antígeno/anticorpo são formados entre o antígeno e o anticorpo em
questão, algum complemento será consumido e, portanto, quando as células
vermelhas cobertas com anticorpo são adicionadas nem todas elas irá
lisar. Pela simples medição da quantidade de lise de células vermelhas
pelos complexos antígeno/anticorpo pela medição da liberação de
hemoglobina no meio, pode-se quantificar indiretamente os complexos
antígeno/anticorpo no tubo. Testes de fixação de complemento são mais
comumente utilizados para pesquisa de anticorpos em uma amostra teste
mas eles podem ser modificados para medição do antígeno.
|
| |
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
Por favor, relate quaisquer problemas para
Richard Hunt
|
|


|
This page last changed on
Wednesday, January 18, 2017
Page maintained by
Richard Hunt
|
