|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA – CAPÍTULO UM
IMUNIDADE INATA (NÃO ESPECÍFICA)
Dr Gene
Mayer
Emeritus Porfessor
University of South Carolina School of Medicine
Tradução:
PhD. Myres Hopkins
|
|
|
|
EM INGLÊS
|
|
EM ESPANHOL |
|
SHQIP -
ALBANÊS |
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
|
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|
|
|
 |
|
|
|
OBJETIVOS
Reconhecer a
significância do sistema imune no combate à infecção e doença
Distinguir entre
sistemas imunes não específico (inato) e específico (adaptativo)
Compreender os
mecanismos de combate a infecções/doenças (eliminação de patógenos)
Conhecer os componentes
humorais e celulares da imunidade não específica
Compreender o mecanismo de ação dos componentes humorais e celulares da
imunidade não específica
 Figura 1
Figura 1
Visão geral do sistema imune
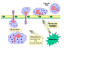
 Figura 2
Figura 2
Células do sistema imune
 Figura 3
Figura 3
Desenvolvimento das células do sistema imune
|
I. VISÃO GERAL
DO SISTEMA IMUNE
Estamos constantemente expostos a
agentes infecciosos e mesmo assim, na maioria dos casos somos capazes de
resistir a essas infecções. É o nosso sistema imune que nos permite
resistir a infecções. O sistema imune é composto de duas subdivisões
principais: O sistema inato ou não específico e o sistema imune
adaptativo ou específico (Figura 1). O sistema inato é nossa primeira
linha de defesa contra organismos invasores enquanto que o sistema imune
adaptativo age como uma segunda linha de defesa e também protege contra
re-exposição ao mesmo patógeno. Cada uma dessas subdivisões principais
do sistema imune tem tanto componentes celulares como humorais, através
dos quais elas executam suas funções de proteção (Figura 1). Além disso,
o sistema imune inato também tem aspectos anatômicos que funcionam como
barreiras à infecção. Embora esses dois ramos do sistema imune tenham
funções distintas, há interconexão entre eles (isto é, componentes do
sistema imune inato influenciam o sistema imune adaptativo e
vice-versa).
Embora ambos os sistemas imunes inato
e adaptativo funcionem na proteção de organismos invasores, eles diferem
de várias maneiras. O sistema imune adaptativo requer algum tempo para
reagir contra um organismo invasor, enquanto que o sistema imune inato
inclui sistemas de defesa que, em sua maior parte, estão
constitutivamente presentes e prontos para serem mobilizados em uma
infecção. Segundo, o sistema imune adaptativo é específico para um
antígeno e reage somente contra o organismo que induz a resposta. Em
contraposição, o sistema imune inato não é específico para um antígeno e
reage da mesma maneira para uma variedade de organismos. Finalmente, o
sistema adaptativo possui memória imunológica. Ele “lembra” que já
encontrou um organismo invasor e reage mais rapidamente à exposição
subseqüente do mesmo organismo. Ao contrário, o sistema imune inato não
possui memória imunológica.
Todas as
células do sistema imune têm sua origem na medula óssea e elas incluem
células mielóides (neutrófilos, basófilos, eosinófilos, macrófagos e
células dendríticas) e linfóides (linfócitos B, linfócitos T e células
assassinas naturais ou células NK [do Inglês Natural Killer])
(Figura 2), que se diferenciam segundo etapas diferentes (Figura 3). A
célula mielóide progenitora (tronco) na medula óssea produz eritrócitos,
plaquetas, neutrófilos, monócitos/macrófagos e células dendríticas
enquanto que células linfóides progenitoras (tronco) produzem células
NK, T e B. Para o desenvolvimento das células T as células precursoras
de células T devem migrar para o timo onde sofrem diferenciação em dois
tipos distintos de células T, as células T auxiliares CD4+ e as células
T pré-citotóxicas CD8+. Dois tipos de células T auxiliares são
produzidos no timo: As células TH1, que ajudam as células
pré-citotóxicas CD8+ a se diferenciarem em células T e as TH2, que
ajudam as células B a se diferenciarem em plasmócitos, que secretam
anticorpos.
A principal função do sistema imune é
a discriminação do próprio/não próprio. Esta habilidade de distinguir
entre o próprio e não próprio é necessária para proteger o organismo
contra invasores patogênicos e para eliminar células modificadas ou
alteradas (ex. células malignas). Uma vez que patógenos podem replicar
intracelularmente (vírus e algumas bactérias e parasitas) ou
extracelularmente (a maioria das bactérias, fungos e parasitas),
diferentes componentes do sistema imune evoluíram para proteger contra
esses diferentes tipos de patógenos. É importante lembrar que a infecção
por um organismo não necessariamente significa doença, uma vez que o
sistema imune na maioria dos casos será capaz de eliminar a infecção
antes que a doença ocorra. Doença ocorre quando o nível de infecção é
elevado, quando a virulência do organismo invasor é grande ou quando a
imunidade está comprometida. Embora o sistema imune, em sua maior parte,
tenha efeitos benéficos, podem ocorrer efeitos detrimentais também.
Durante a inflamação, que é a resposta a um organismo invasor, pode
haver desconforto local e danos colaterais a tecidos sadios como
resultado dos produtos tóxicos da resposta imune. Além disso, em alguns
casos a resposta imune pode ser dirigida a tecidos próprios resultando
em doença autoimune.
|
Tabela 1 |
|
Imunidade Não Específica |
Imunidade Específica |
|
A resposta é independente de antígeno |
A resposta é dependente de antígeno |
|
Há resposta imediata e máxima |
Há período de latência entre a exposição e a resposta máxima |
|
Não específica a antígeno |
Específica a antígeno |
|
Exposição não resulta em memória imunológica |
Exposição resulta em memória imunológica |
|
| |
II. IMUNIDADE INATA (NÃO-ESPECÍFICA)
Os elementos do sistema imune inato (não específico (Tabela 2) incluem barreiras
anatômicas, moléculas de secreção e componentes celulares. Entre as barreiras
mecânicas anatômicas estão a pele e camadas epiteliais internas, o movimento dos
intestinos e a oscilação dos cílios bronco-pulmonares. Associados a essas
superfícies protetoras estão agentes químicos e biológicos.
A. Barreiras anatômicas a infecções
1. Fatores mecânicos
As superfícies epiteliais formam uma barreira física que é muito impermeável
à maioria dos agentes infecciosos. Dessa forma, a pele age como nossa
primeira linha de defesa contra organismos invasores. A descamação do
epitélio da pele também ajuda a remover bactéria e outros agentes
infecciosos que aderiram às superfícies epiteliais. Movimentos devido aos
cílios e à peristalse ajuda a manter as vias aéreas e o trato
gastrointestinal livres de organismos. O fluir das lágrimas e saliva ajuda a
prevenir infecção nos olhos e na boca. O efeito pegajoso do muco que cobre o
trato respiratório e gastrointestinal ajuda a proteger os pulmões e o
sistema digestivo contra as infecções.
2. Fatores químicos
Os ácidos graxos no suor inibem o crescimento de bactéria. Lisozima e
fosfolipase encontrados na lágrima, saliva e secreção nasal podem destruir a
parede celular da bactéria e desestabilizar as membranas bacterianas. O
baixo pH do suor e da secreção gástrica previnem o crescimento de bactéria.
Defensinas (proteínas de baixo peso molecular) encontradas nos pulmões e no
trato gastrointestinal têm atividade antimicrobiana. Agentes surfactantes
nos pulmões agem como opsoninas (substâncias que promovem fagocitose de
partículas pelas células fagocitárias).
3. Fatores biológicos
A flora normal da pele e no trato gastrointestinal pode prevenir a
colonização de bactéria patogênica pela secreção de substâncias tóxicas ou
pela competição com bactéria patogênica por nutrientes ou pela ligação à
superfície da célula.
B. Barreiras humorais à infecção
As barreiras anatômicas são muito eficientes na prevenção da colonização de
tecidos por microrganismos. Entretanto, quando há lesão em tecidos as barreiras
anatômicas são rompidas e a infecção pode ocorrer. Uma vez penetrados nos
tecidos os agentes infecciosos, outro mecanismo de defesa inato entra em ação, o
qual chamamos de inflamação aguda. Fatores humorais têm um papel importante na
inflamação, que se caracteriza por edema e o recrutamento de células
fagocitárias.
Esses fatores humorais são encontrados no soro ou são formados no local da
infecção.
1. Sistema complemento – O sistema complemento é o principal mecanismo de
defesa humoral não específico (ver capítulo sobre complemento). Uma vez
ativado o complemento pode levar ao aumento da permeabilidade vascular,
recrutamento de células fagocitárias, e lise e opsonização de bactéria.
2. Sistema de coagulação – Dependendo da severidade da lesão no tecido, o
sistema de coagulação poderá ou não ser ativado. Alguns produtos do sistema
de coagulação podem contribuir para a defesa específica devido a sua
habilidade de aumentar a permeabilidade vascular e agir como agente
quimiotáctico para células fagocitárias. Além disso, alguns dos produtos do
sistema de coagulação são antimicrobianos por si só. Por exemplo, a beta-lisina,
uma proteína produzida pelos plaquetas durante a coagulação pode lisar
muitas bactérias Gram positivas ao agir como detergentes catiônicos.
3. Lactoferrina e transferrina – Ao se ligarem com o ferro, um nutriente
essencial para bactéria, essas proteínas limitam o crescimento bacteriano.
4. Interferons – Interferons são proteínas que podem limitar a replicação de
vírus nas células.
5. Lisozima – Lisozima degrada a parede celular da bactéria.
6. Interleucina-1 – Il-1 induz febre e a produção de proteínas de fase aguda,
algumas das quais são antimicrobianos porque elas podem opsonizar bactéria.
|
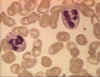 Figura 4A Dois neutrófilos em esfregaço
sanguíneo, arquivo de Imagem da © Bristol Biomedical, utilizado com
permissão.
Figura 4A Dois neutrófilos em esfregaço
sanguíneo, arquivo de Imagem da © Bristol Biomedical, utilizado com
permissão.
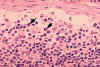 Figura 4B
Histopatologia tipo linfadenopatia devido a infeção por HIV-1. Seio
subcapsular. O seio contém número elevado de neutrófilos. CDC/Dr. Edwin
P. Ewing, Jr.
epe1@cdc.gov
Figura 4B
Histopatologia tipo linfadenopatia devido a infeção por HIV-1. Seio
subcapsular. O seio contém número elevado de neutrófilos. CDC/Dr. Edwin
P. Ewing, Jr.
epe1@cdc.gov
 Figura 4C
Figura 4C
Neutrófilo- eletromicrografia. Note os dois lobos nucleares e os
grânulos azurófilos © Dr Louise Odor, Universidade da Carolina do Sul,
Escola de Medicina
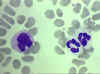 Figure 4D
Esfregaço sanguíneo mostrando um monócito (esquerda) e dois neutrófilos
arquivo de Imagem da © Bristol Biomedical, utilizado com permissão
Figure 4D
Esfregaço sanguíneo mostrando um monócito (esquerda) e dois neutrófilos
arquivo de Imagem da © Bristol Biomedical, utilizado com permissão
|
|
Tabela 2. Barreiras físico-químicas a infecções |
|
Sistema/Órgão |
Componente ativo |
Mecanismo efetor |
|
Pele |
Células de descamação; Suor |
Descamação; fluxo secretor, ácidos orgânicos |
|
Trato GI |
Células colunares |
Peristalse, baixo pH, ácidos biliares, fluxo secretor, tiocianato |
|
Pulmão |
Cílios traqueais |
Elevador mucociliar, surfactante |
|
Nasofaringe e olhos |
Muco, saliva, lágrima |
Fluxo secretor, lisozima |
|
Circulação e órgãos linfóides |
Células
fagocitárias
Células
NK e K
LAK |
Fagocitose e morte intracelular
Citólise direta e dependente de citólise
Citólise ativada por IL2 |
|
Soro |
Lactoferrina
e Transferrina |
Ligação ao ferro |
|
Interferons |
Proteínas antivirais |
| TNF-alpha |
Antiviral,
ativação fagocitária |
|
Lisozima |
Hidrólise de peptidoglicano |
|
Fibronectina |
Opsonização e fagocitose |
|
Complemento |
Opsonização, fagocitose aumentada, inflamação |
|
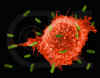 Figura 5
Figura 5
Macrófago Atacando E.coli (MEV x8,800) ©
Dr Dennis Kunkel
(utilizado com permissão)
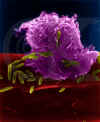 Figura 6
Figura 6
Macrófago Alveolar (Pulmão) Macrófago Atacando E. coli (MEV
x10,000) ©
Dr
Dennis Kunkel
(utilizado
com permissão)
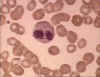 Figura 6A
Eosinófilo em esfregaço sanguíneo. Arquivo de Imagem da © Bristol
Biomedical Utilizado com permissão
Figura 6A
Eosinófilo em esfregaço sanguíneo. Arquivo de Imagem da © Bristol
Biomedical Utilizado com permissão
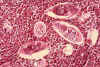 Figura 6B
Figura 6B
Histopatologia da bexiga mostra ovos de Schistosoma haematobium
rodeado por infiltrados intensos de eosinófilos CDC/Dr. Edwin P. Ewing, Jr.
epe1@cdc.gov
 Figura 7
Figura 7
Histiócitos –Macrófagos residentes de vida longa encontrados no interior de
tecidos. Arquivo de Imagem da © Bristol Biomedical, utilizado com permissão
 Figura 8
Monócito com parasita da malária ingerido. CDC/Dr. Melvin
Figura 8
Monócito com parasita da malária ingerido. CDC/Dr. Melvin
 Figura
9 Resposta quimiotáctica a estímulo inflamatório
Figura
9 Resposta quimiotáctica a estímulo inflamatório |
C. Barreiras celulares à infecção
Parte da resposta inflamatória é o recrutamento de
eosinófilos polimorfonucleares e macrófagos ao local da infecção. Essas
células são a principal linha de defesa no sistema imune não específico.
1. Neutrófilos – Células polimorfonucleares (PMNs, figura
4) são recrutadas ao local da infecção onde fagocitam organismos invasores e os
mata intracelularmente. Além disso, PMNs contribuem para lesões colaterais no
tecido que ocorrem durante a inflamação.
2. Macrófagos – Macrófagos tissulares (figura 5, 6, 7) e monócitos recentemente
recrutados (figura 4 e 8), que se diferenciam em macrófagos, também funcionam na
fagocitose e na morte intracelular de microrganismos. Além disso, macrófagos
contribuem para o reparo de tecidos e agem como células apresentadoras de
antígenos, que são requeridas para a indução de respostas imunes específicas.
3. Células assassinas naturais (NK) e células assassinas ativadas por linfocina
(LAK) – Células NK e LAK podem matar células tumorais infectadas por vírus de
maneira não específica. Essas células não são parte da resposta inflamatória,
mas são importantes na imunidade não específica a infecções virais e na
prevenção de tumores.
4. Eosinófilos – Eosinófilos (figura 6a e b) têm proteínas em grânulos que são
eficientes na destruição de certos parasitas.
III. FAGOCITOSE E
MORTE INTRACELULAR
A. Células fagocitárias
1. Neutrófilos/Células
polimorfonucleares
PMNs são células fagocitárias móveis com núcleo lobulado. Elas podem ser
identificadas pelas características do núcleo ou pela presença de um antígeno na
superfície da célula chamado CD66. Elas contêm dois tipos de grânulos cujos
conteúdos estão envolvidos nas propriedades antimicrobianas dessas células. Os
grânulos primários ou
azurófilos, que são abundantes em PMNs recém formados, contêm proteínas
catiônicas e
defensinas que podem matar bactéria, enzimas proteolíticas como elastase, e
catepsina G para degradar proteínas, lisozima para degradar paredes celulares, e
caracteristicamente, mieloperoxidase, que está envolvida na geração de compostos
bactericidas. O segundo tipo de grânulo encontrado em PMNs mais maduros é o
grânulo secundário ou específico. Estes contêm lisozima, componentes da NADPH
oxidase, que está envolvido na geração de produtos tóxicos de oxigênio, e
caracteristicamente lactoferrina, uma proteína queladora de ferro e proteína
ligadora a B12.
2. Monócitos/Macrófagos – Macrófagos são células fagocitárias que têm como
característica o núcleo na forma de rim. Elas podem ser identificadas
morfologicamente ou pela presença do marcador de superfície CD14. Ao contrário
dos PMNs elas não contêm grânulos, mas têm numerosos lisossomos com conteúdos
similares aos dos grânulos do PMNs.
B. Resposta de
fagócitos a infecção
PMN circulantes e monócitos respondem ao perigo (sinais SOS) gerado no local da
infecção. Os sinais SOS incluem peptídeos contento
N-formil-metionina liberados pela bactéria, peptídeos do sistema de
coagulação, produtos do complemento e citocinas liberadas dos macrófagos
tissulares que encontraram bactéria no tecido. Alguns dos sinais SOS estimulam
células endoteliais próximas do local da infecção que passam a expressar
moléculas de adesão tais como ICAM-1 e selectinas que ligam a componentes da
superfície das células fagocitárias provocando a aderência dos fagócitos ao
endotélio. Vasodilatadores produzidos no local da infecção provocam o
afrouxamento das junções entre as células endoteliais e os fagócitos então
atravessam a barreira endotelial “espremendo-se” entre as células endoteliais
através de um processo chamado
diapedese (Figura 9). Uma vez formados espaços no tecido alguns dos sinais
SOS atraem fagócitos ao local da infecção por quimiotaxia (movimento em direção
a um gradiente químico). Os sinais SOS também ativam os fagócitos, o que resulta
em um aumento da fagocitose e morte intracelular dos organismos invasores. |
 Figura 10
Aderência de bactéria via receptores
Figura 10
Aderência de bactéria via receptores |
C. Iniciação da Fagocitose
(Figura 10)
Células fagocitárias têm uma variedade de receptores em suas membranas
através dos quais agentes infecciosos se ligam às células. Eles incluem:
1. Receptores Fc – Bactérias com
anticorpo IgG em sua superfície têm a região Fc exposta e esta parte da
molécula de Ig se liga ao receptor nos fagócitos. A ligação ao receptor Fc
requer interação prévia do anticorpo com o antígeno. A ligação de bactéria
coberta com IgG aos receptores Fc levam ao aumento da fagocitose e da
atividade metabólica dos fagócitos (queima respiratória).
2. Receptores do complemento–
Células fagocitárias têm um receptor para o terceiro componente do
complemento: C3b. A ligação de bactéria coberta com C3b a este receptor
também leva ao aumento da fagocitose e à queima respiratória.
3. Receptores scavenger – Receptores
scavenger (do Inglês scavenger = removedor) ligam-se a uma variedade
de poliânions na superfície bacteriana levando à sua fagocitose.
4. Receptores tipo Toll - Células
fagocitárias têm uma variedade de receptores tipo Toll ou PRRs (do Inglês
Pattern Recognition Receptors) que reconhecem classes de padrões
moleculares chamados PAMPs (do Inglês Pathogen Associated Molecular
Patterns) em agentes infecciosos. A ligação de um agente infeccioso via
receptores tipo Toll resulta na fagocitose e na liberação de citocinas
inflamatórias (IL-1, TNF-alfa e IL-6) pelas células fagocitárias.
|
| |
D.
Fagocitose
Após a ligação a uma bactéria, a célula fagocitária começa a estender
pseudópodos próximo à bactéria. Estes eventualmente envolvem a bactéria e a
engolfam, sendo a mesma enclausurada em um
fagossomo. Durante a fagocitose os grânulos ou lisossomos da célula
fagocitária se fusionam como o fagossomo e esvaziam seus conteúdos. O resultado
é uma bactéria engolfada em um
fagolisossomo que contém os conteúdos dos grânulos ou lisossomos.
|
|
|
|
FILME
Quimiotaxia dos Neutrófilos(Inglês)
Baixa Resolução (Quicktime)
Alta Resolução (Quicktime)
© Mondo Media, San Francisco, Calif., USA
e
The MicrobeLibrary
|
FILME
Fagocitose
Quicktime
© James A. Sullivan, CellsAlive! Video, Charlottesville, Va., USA
e
The
MicrobeLibrary
FILME
(Inglês)
Fagocitose e Patógenos Bacterianos
Flash Tutorial interativo
© Thomas M. Terry
University of Connecticut
Storrs, CT 06269 USA
e
The MicrobeLibrary |
|
 Figura 11
Figura 11
A. Queima respiratória: Reações dependentes de oxigênio,
independentes de mieloperoxidase
 B. Queima respiratória: Reações dependentes de oxigênio, dependentes de
mieloperoxidase
B. Queima respiratória: Reações dependentes de oxigênio, dependentes de
mieloperoxidase |
E. Queima respiratória e morte intracelular
Durante a fagocitose há um aumento no consumo de glicose e oxigênio, o que é
referido como queima respiratória. A conseqüência da queima respiratória é a
produção de uma quantidade de compostos de oxigênio, que matam a bactéria
fagocitada. Esta é a chamada morte intracelular dependente de oxigênio. Além
disso, a bactéria pode ser destruída por substâncias previamente produzidas e
liberadas dos grânulos ou lisossomas quando estes fusionam com o fagossomo. Esta
é a chamada morte intracelular independente de oxigênio.
1. Morte intracelular dependente
de oxigênio e independente de mieloperoxidase (Figura11A)
Durante a fagocitose a glicose é metabolizada pela via da
pentose monofosfato e o NADPH é formado. O citocromo B, que faz parte do
grânulo específico, combina com a NADPH oxidase da membrana plasmática,
ativando-a. A NADPH oxidase ativada usa oxigênio para oxidar o NADPH. O
resultado é a produção de ânion superóxido. Alguns dos ânions superóxidos são
convertidos a H2O2 e oxigênio singleto pela superóxido dismutase. Além disso, o
ânion superóxido pode reagir com H2O2 resultando na formação de radical
hidroxílico e mais oxigênio singleto. O resultado de todas essas reações é a
produção dos compostos de oxigênio tóxicos: Ânion superóxido (O2-), H2O2,
oxigênio singleto (1O2) e radical hidroxila (OH•).
2. Morte intracelular dependente de oxigênio e dependente de mieloperoxidase
(Figura 11B)
À medida que os
grânulos azurófilos se fusionam com o fagossomo, mieloperoxidase é liberada
no fagolisossomo. Mieloperoxidase utiliza H2O2 e íons
haletos (normalmente Cl-) para produzir hipoclorito, uma substância muito
tóxica. Alguns dos hipocloritos podem se decompor espontaneamente para
produzir oxigênio singleto. O resultado dessas reações é a produção de
hipoclorito tóxico (OCl-) e oxigênio singleto (1O2).
3. Reações de detoxificação (Tabela 3)
PMNs e macrófagos têm maneiras de se proteger contra os intermediários de
oxigênio. Essas reações envolvem a
dismutação do ânion superóxido a peróxido de hidrogênio pela superóxido
dismutase e a conversão de peróxido de hidrogênio em água pela catalase.
|
Tabela 3 |
|
Reação |
Enzima |
| H2O2 + Cl-
--> OCl- + H2O |
Mieloperoxidase |
| OCl- + H2O
--> 1O2
+Cl- + H2O |
| 2O2 + 2H+
--> O2-
+ H2O2 |
Superóxido dismutase |
| H2O2 --> H2O + O2 |
Catalase |
4. Morte intracelular independente de oxigênio (tabela 4)
Além do mecanismo de morte dependente de oxigênio há também o mecanismo de
morte independente de oxigênio em fagócitos: Proteínas catiônicas
(catepsinas) liberadas no fagolisossomo podem danificar membranas
bacterianas; lisozima degrada paredes celulares bacterianas; lactoferrina
quela
ferro, que impede a bactéria de utilizar este nutriente necessário; enzimas
hidrolíticas degradam proteínas bacterianas. Dessa forma, mesmo pacientes
que têm defeitos nas etapas de morte dependente de oxigênio são capazes de
matar bactéria. Entretanto, como os mecanismos dependentes de oxigênio são
muito mais eficientes em matar, pacientes com defeitos nesses mecanismos são
mais susceptíveis e têm infecções mais sérias.
|
Tabela 4. Mecanismos de morte intracelular independentes de oxigênio |
|
Molécula efetora |
Função |
|
Proteínas
catiônicas (incluindo catepsinas) |
Danificam
membranas microbianas |
|
Lisozima |
Separa
mucopeptídeos em parede celular bacteriana |
|
Lactoferrina |
Priva de ferro bactérias em proliferação |
|
Enzimas proteolíticas e hidrolíticas |
Digestão de organismos mortos |
|
 Figura
12 Morte dependente de óxido nítrico Figura
12 Morte dependente de óxido nítrico |
IV.
MORTE DEPENDENTE DE ÓXIDO NÍTRICO
A ligação de bactéria a macrófagos, particularmente ligação via
receptores tipo Toll, resulta na produção de TNF-alfa, que age de
maneira autócrina para induzir a expressão do gene induzível da óxido
nítrico sintetase (i-nos ) resultando na produção de óxido nítrico (NO)
(figura 12). Se a célula é também exposta ao gama interferon (IFN-gama)
é produzido óxido nítrico adicional (figura 12). O óxido nítrico
liberado pela célula é tóxico e pode matar microrganismos na vizinhança
do macrófago.
|
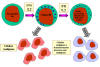 Figura 13 Células NK e sua ativação
Figura 13 Células NK e sua ativação
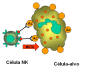 Figura 14
Figura 14
Morte de alvo opsonizado por células NK.
|
V. CÉLULAS ASSASSINAS
NÃO ESPECÍFICAS
Algumas células incluindo NK e LAK,
células K, macrófagos ativados e eosinófilos são capazes de matar células-alvo
próprias alteradas de maneira não específica. Essas células têm papel importante
no sistema imune inato.
A. Células NK e LAK
Células assassinas naturais ou células
NK são também conhecidas como grandes linfócitos granulares ou células LGL (do
Inglês Large Granular Lymphocytes) porque se assemelham com linfócitos em
sua morfologia, exceto pelo fato de serem um pouco maiores e terem numerosos
grânulos. Células NK podem ser identificadas pela presença dos marcadores de
superfície CD56 e CD16 e pela falta de CD3. Células NK são capazes de matar
células-alvo infectadas por vírus ou malignas, mas são relativamente
ineficientes nessa tarefa. Entretanto, ao serem expostas a IL-2 e IFN-gama,
células NK tornam-se células assassinas ativadas por linfocina ou LAK (do
Inglês Lymphokine-Activated Killer), que são capazes de matar células
malignas. Exposição continuada a IL-2 e IFN-gama habilita células LAK a matar
células transformadas e malignas. Terapia com células LAK é uma abordagem para o
tratamento de malignidades.
Como células NK e LAK distinguem uma célula normal de uma célula infectada por
vírus ou maligna? Células NK e LAK têm dois tipos de receptores em sua
superfície – um receptor ativador de função assassina ou receptor KAR (do
Inglês Killer Activacting Receptor) e um receptor inibidor de função
assassina ou receptor KIR (do Inglês Killer Inhibiting Receptor). Quando
KAR encontra o seu ligante, um ligante ativador de função assassina (KAL) na
célula-alvo a célula NK ou LAK, é capaz de matar o alvo. Entretanto, se o KIR
também se liga a este ligante então a morte é inibida mesmo que KAR se ligue a
KAL. Os ligantes para KIR são moléculas de MHC classe I. Assim, se uma
célula-alvo expressa moléculas de MHC classe I esta não vai ser morta por
células NK ou LAK mesmo que o alvo também tenha um KAL que não pode se ligar a
KAR.Células normais constitutivamente expressam moléculas de MHC classe I na sua
superfície, entretanto, células infectadas por vírus e células malignas têm
diminuída a expressão de MHC classe I. Dessa forma, células NK e LAK matam
seletivamente células infectadas por vírus e células malignas, deixando livres
as células normais.
B. Células K (Figura 14)
Células assassinas (K) não são um tipo de célula morfologicamente distinto. Pelo
contrário, uma célula K é qualquer célula que media a citotoxicidade celular
dependente de anticorpo (ADCC). Em ADCC o anticorpo age como um conector que
aproxima a célula K e a célula-alvo para que a morte ocorra. Células K têm em
sua superfície um receptor Fc para anticorpo e assim elas podem reconhecer,
ligar e matar células-alvo cobertas com anticorpo. Células assassinas que têm
receptores Fc incluem NK, LAK, e macrófagos que têm um receptor Fc para
anticorpos IgG e eosinófilos que têm um receptor Fc para anticorpos IgE.
|
| |
Todos os componentes do sistema imune não específico estão modulados por
produtos do sistema imune específico, tais como interleucinas,gama
interferon, anticorpos, etc. |
|
Nesse estágio você deverá saber o
seguinte:
1. Diferenças entre as funções do sistema
imune não específico e específico.
2. Componentes humorais do sistema imune
não específico e suas ações.
3. Componentes celulares do sistema imune
não específico e suas ações.
4. Etapas da morte intracelular de
bactéria pelos fagócitos e suas características.
5. Efeito dos componentes humorais tais como interferon, TNF, IL-2, complemento
etc. nos componentes celulares do sistema imune não específico. |
|
Tabela 5. Características das células envolvidas na resistência não
específica |
|
Célula efetora |
Marcador identificador e/ou função |
|
CD3 |
Ig |
Fc |
CD |
Fagocitose |
|
Neutrófilo
Macrófago
Célula NK
Células K
Célula LAK
Eosinófilo |
-
-
-
-
-
- |
-
-
-
-
-
- |
IgG
IgG
IgG
IgG
?
IgE |
CD67
CD14
CD56 & 16
?
?
CD67 |
+
+
-
-
?
-
|
|
|

|
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
|

 Figura 4A Dois neutrófilos em esfregaço
sanguíneo, arquivo de Imagem da © Bristol Biomedical, utilizado com
permissão.
Figura 4A Dois neutrófilos em esfregaço
sanguíneo, arquivo de Imagem da © Bristol Biomedical, utilizado com
permissão.
 Figura 5
Figura 5 Figura 10
Aderência de bactéria via receptores
Figura 10
Aderência de bactéria via receptores Figura 13 Células NK e sua ativação
Figura 13 Células NK e sua ativação














